流体剪切应力通过 JNK 信号诱导循环肿瘤细胞的 EMT
癌症已成为全球人类死亡的第二大原因,超过 90% 的癌症相关死亡归因于转移性传播。肿瘤细胞主要通过血行播散转移到远端器官。因此,循环肿瘤细胞 (CTC) 在血管系统中的存活对整个转移过程的效率至关重要。
CTC 离开具有保护作用的原发肿瘤微环境并进入血管后,处于悬浮状态,易受血液循环中各种因素的影响。然而,仍然存在一小部分 CTC 亚群,它们可以在血行播散中存活并最终在远端器官中产生转移。因此,揭示肿瘤细胞在血液循环过程中的生存机制对于有效预防肿瘤转移至关重要。
尽管各种生化因子在 CTC 存活和转移中具有重要作用,但细胞具有感知机械刺激的能力,这些机械刺激可通过机械转导转化为生化信号。流体剪切应力促进贴壁肿瘤细胞的上皮-间充质转化 (EMT),上皮细胞通过这一过程向间充质细胞状态过渡,并增强细胞的运动性和癌症干细胞 (CSC) 的特性。相比之下,流体剪切应力对悬浮肿瘤细胞的影响仍然知之甚少。
EMT 已被证明可以促进肿瘤细胞存活并赋予传统肿瘤细胞 CSC 的特性。除了许多生化信号外,机械刺激也可能影响 EMT 过程。然而,流体剪切应力如何影响悬浮 CTC 的 EMT 表型尚未完全了解。特别是,剪切力诱导的 EMT 变化如何影响血液剪切流中的 CTC 存活尚不清楚。
基于此,香港理工大学深圳研究院以及香港理工大学生物医学工程学系的专家团队进行了更深层次的研究,在 International Journal of Molecular Sciences 上发表了题为《Fluid Shear Stress Induces EMT of Circulating Tumor Cells via JNK Signaling in Favor of Their Survival during Hematogenous Dissemination》的实验论文。
在这项研究中,采用体外循环系统来产生生理水平的流体剪切应力,模拟血液在血管中的剪切流动。当检测细胞活性和 EMT 表型时,将肿瘤细胞在悬浮状态下暴露于各种水平的流体剪切应力下。通过机制研究,探讨剪切介导的 EMT 机制,特别是 c-Jun N-terminal 激酶 (JNK) 信号的转导机制。此外,实验研究了剪切诱导的 EMT 和 JNK 信号通路在 CTCs 在流体剪切流中存活中的作用。最后还分析了 EMT 和 JNK 信号通路与患者存活率之间的相关性。
实验结果
肿瘤细胞在血行播散过程中经历了相当大的流体剪切应力。该实验利用体外系统来模拟血液剪切流(图1)。静脉和动脉循环内的平均剪切应力分别为 0.5-4 dynes/cm2 和 4-30 dynes/cm2。血管系统中 CTCs 的持续时间在 12 小时内。因此,本研究采用 20 dyne/cm2 范围内的流体剪切应力和 12h 内的循环时间。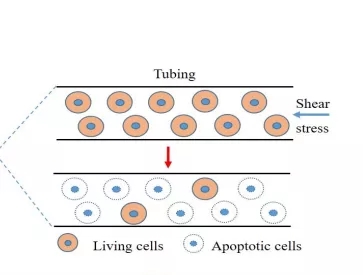
图一
为了探讨流体剪切应力对悬浮肿瘤细胞活性的影响,不同恶性程度的乳腺癌细胞在不同水平的剪切应力下循环不同的时间。结果表明,在一定剪切应力下,悬浮CTCs 的活性随循环时间的延长而逐渐降低(图2 a-d)。在不同时间点,20 dynes/cm2 切应力下的细胞存活率明显低于 0 dynes/cm2 切应力下的细胞存活率。
Annexin V 分析进一步证实了这些发现(图2 e、f)。在四种乳腺癌细胞系中也观察到类似的现象(SKBR3、MCF-7、MDA-MB-468 和 MDA-MB-231;图2)。这些结果表明,流体剪切应力消除了大部分悬浮的 CTCs。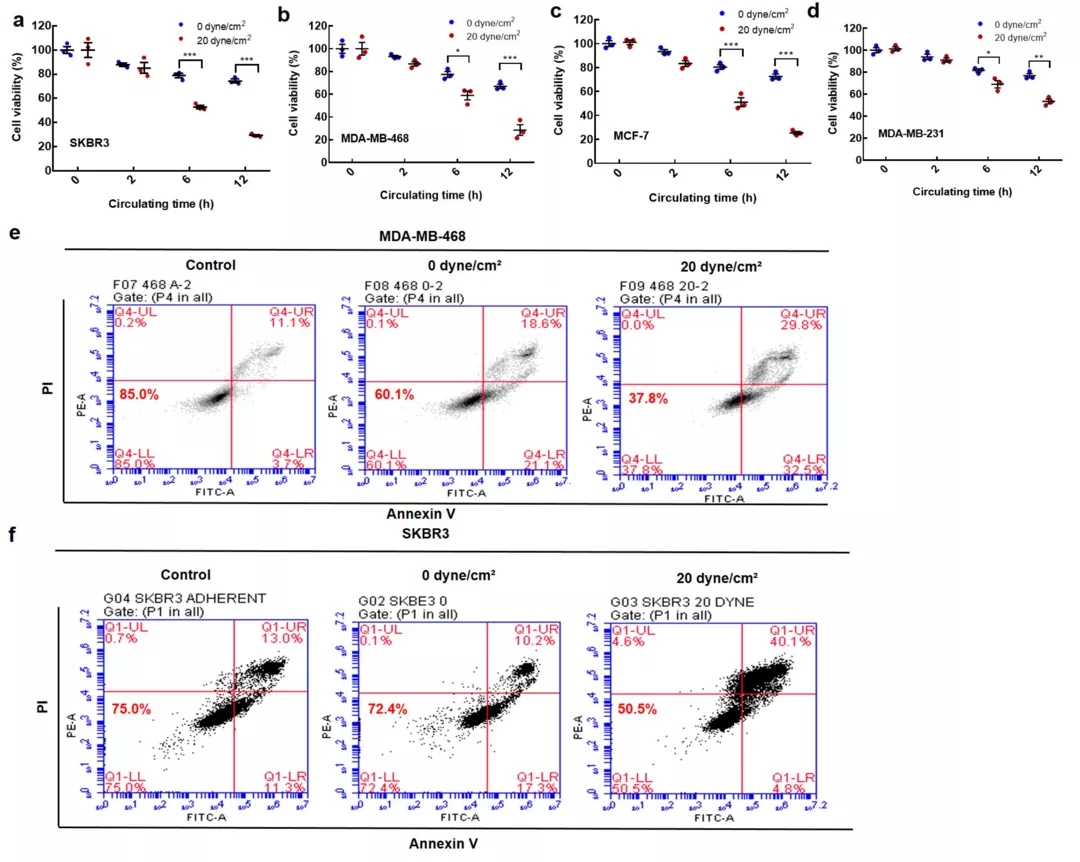
图二
接下来,为了检测流体剪切应力可能通过 JNK 信号通路诱导EMT表型这个假设,研究人员在剪切应力处理后检测了 JNK 信号通路的活性。结果表明,在 SKBR3、MDA-MB-468 和 MCF-7 等多种乳腺癌细胞中,20 dyne/cm2 剪切应力处理后,CTCs 中 JNK 信号的磷酸化水平高于 0 dyne/cm2 的剪切应力处理(图3 a和图4 a、c)。
免疫印迹进一步证实了 JNK 信号的激活,而 JNK 的总水平在对照细胞和剪切处理细胞之间无明显差异(图3 b)。
为了探讨在剪切诱导的 EMT 中的作用,当乳腺癌细胞暴露于流体剪切应力时,JNK 信号通路被调节。茴香霉素,一种 JNK 激活剂,在 20 dyne/cm2 剪切应力的存在下,显着上调间充质标志物的表达,并促进悬浮肿瘤细胞的 EMT 表型(图3 c 和图4 b、d)。
另一方面,JNK 抑制剂 SP600125 在流体剪切应力下增强上皮标志物(EpCAM)的表达,同时抑制间充质标志物(Twist,N-cadherin)的表达(图3 d和图4 b、d)。重要的是,在 20 dyne/cm2 剪切应力处理的细胞中,沉默 JNK 信号会降低 CSV+ 亚群的比例(图3 e),而激活该通路则增加了这一比例。
这些结果表明,抑制/激活 JNK 信号通路可抑制/促进乳腺 CTCs 中剪切诱导的 EMT,提示流体剪切应力可通过 JNK 信号通路诱导悬浮 CTCs 的 EMT。
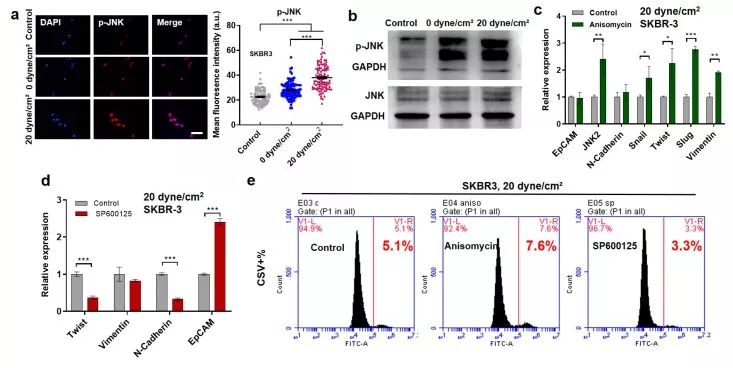
图三
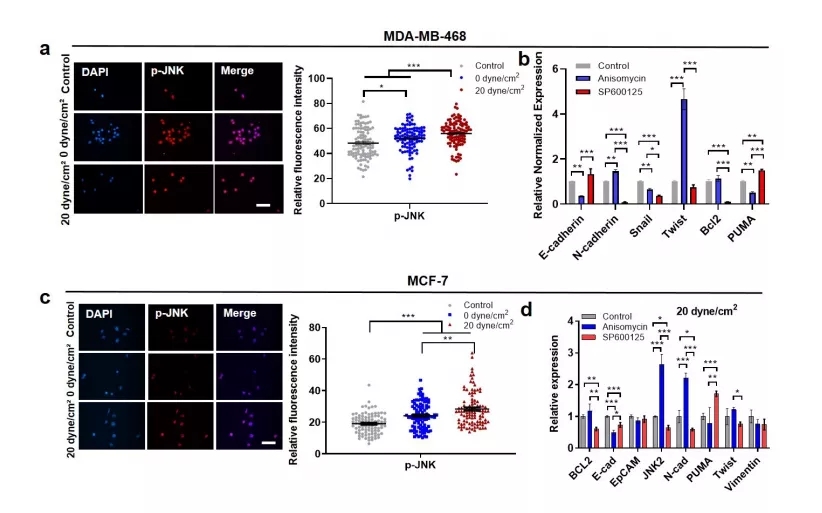
图四
此外,该实验还表明,流体剪切应力促进上皮细胞向间充质细胞的转变,并维持预先存在的间充质亚群的表型。
然后,实验还研究了剪切诱导的 EMT 对悬浮 CTCs 在流体剪切应力下的存活的影响。结果显示,0 和 20 dyne/cm2 剪切应力处理后存活的肿瘤细胞比未处理的细胞具有更高的生存能力,提示剪切诱导的 EMT 与剪切流下较高的生存能力相关。然后进一步探讨了在剪切应力下 EMT 在 CTCs 存活中的作用。最终结果表明,剪切诱导的 EMT 表型促进了 CTCs 在血液剪切流中的存活。
最后,实验进一步检测了患者肿瘤和 CTCs 中 EMT 基因、Bcl-2 和 JNK 靶基因 JUN 的表达与乳腺癌患者存活率之间的相关性。结果显示,这些基因的高表达促进了 CTCs 在血液剪切应力下的存活,这可能会增加转移风险并降低患者存活率。
实验结论
该研究表明,血液循环中的流体剪切应力不仅消除了大部分悬浮的 CTCs,而且通过 JNK 信号将上皮肿瘤细胞转变为间充质状态,并维持预先存在的间充质细胞的表型,从而促进了存活肿瘤细胞中的 EMT 表型。重要的是,剪切诱导的 EMT 通过抑制 PUMA 的表达和激活 JNK 信号通路,促进悬浮 CTCs 在血液剪切应力下的存活。
此外,EMT 基因和 JNK 基因 JUN 的表达与患者存活率低相关。该研究发现揭示了血液循环中流体剪切应力对CTCs 的双重影响,并为力学在肿瘤转移中的作用提供了新的见解。
参考文献:Xin Y, Li K, Yang M, Tan Y. Fluid Shear Stress Induces EMT of Circulating Tumor Cells via JNK Signaling in Favor of Their Survival during Hematogenous Dissemination. Int J Mol Sci. 2020 Oct 30;21(21):8115. doi: 10.3390/ijms21218115. PMID: 33143160; PMCID: PMC7663710.
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。了解更多资讯欢迎关注Naturethink!