内皮细胞(EC)排列在所有器官血管系统的管腔侧,其独特的位置可以应对全身威胁,例如脓毒症。脓毒症有时被称为“血液中毒”,是一种危及生命的由细菌等病原微生物侵入机体引起的全身炎症反应综合征。脓毒症会导致内皮功能严重受损,包括血管舒缩调节、屏障功能、炎症和凝血,从而导致微循环病理和器官衰竭。
脓毒症开始于血管和剪切应力(SS)功能障碍、氧化应激和炎症反应增加、糖萼脱落、EC 连接破坏并伴有血屏障丧失、旁分泌和/或自分泌紊乱、白细胞粘附和外渗增强以及激活凝血系统和抑制纤溶系统。血管壁上最重要的生理压力是流动血液的切向摩擦力。来自层流的正常 SS 水平通过涉及糖萼的机械转导机制具有强大的稳态作用。EC 调节血流,因此当病原体损坏糖萼并使 EC 功能失调时,炎症和凝血的级联反应会升级,如果不纠正,将会导致死亡。这些级联是目前脓毒症治疗的诊断焦点。EC 功能障碍的介质可能是治疗败血症的新靶点。维持血管壁足够的 SS 循环可以减少炎症及其后遗症,并改善抗感染药物的输送。SS 在脓毒症中对 EC 活性的作用及其在早期介入治疗中的意义尚未进行过综述。基于此,美国俄克拉荷马医学研究基金会心血管生物学项目评估了 SS 对 EC 功能障碍,以及脓毒症期间的血流动力学、炎症、凝血功能障碍和屏障丧失的后遗症的影响。该团队假设血流和生理 SS 的恢复有助于恢复 EC 功能,并降低发病率和死亡率。

脓毒症期间的循环衰竭严重损害 SS 机械转导并引发病理变化。图1 比较了层流 SS 对 EC 的正常稳态作用与低流量和 SS 在脓毒症中的功能失调作用。左图:正常内皮接受来自层流模式的生理(~15 dynes/cm2 )剪切应力。内皮表现出静止的梭形光滑形态,抗凝剂/抗血栓和抗氧化剂物质的产生增加。内分泌状态也支持静止状态。右图:由低剪切应力(<5 dynes/cm2)导致的内皮功能障碍。内皮表现出高凝状态/促血栓形成和促氧化状态。列出的自分泌和旁分泌变化导致了这种功能失调的血管器官。体外和体内研究表明,脓毒症中层流血流的恢复和足够的剪切应力将使内皮细胞趋于稳态。

图1 正常和减少的剪切应力对血管壁的影响。
脓毒症期间的器官功能障碍是由宿主对感染的多因素反应引起的。对侵入性病原体的免疫反应引发“细胞因子风暴”,其中促炎细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)1β、IL-6、IL-12 和 IL-17 最重要的。脓毒症期间引发的促炎反应涉及补体系统、凝血级联、血管内皮、中性粒细胞和血小板。作为血管系统稳态调节的一部分,SS 在调节 EC 炎症反应中起着关键作用。通过抑制炎性丝裂原活化蛋白激酶(MAPK)和核因子-κB 通路,SS 介导的 EC 粘附分子和炎症蛋白的下调通常可以防止白细胞与血管壁的粘附。不足的低 SS,如脓毒症,会促进炎症信号传导。因此,当糖萼脱落且 EC 功能失调时,EC 抗炎保护的额外丧失会加剧由传染原引起的炎症反应。脓毒症引起的炎症也可能因内皮微粒(EMP)的释放而加重。正常 SS 抑制 EMP 释放,SS 不足以及其他脓毒症诱导的损伤 EC 因子(例如炎性细胞因子、细菌脂多糖、缺氧和氧化应激、凝血酶)可以增强 EMP 释放。 图2 总结了脓毒症引起的弥散性血管内凝血(DIC)的一系列事件。
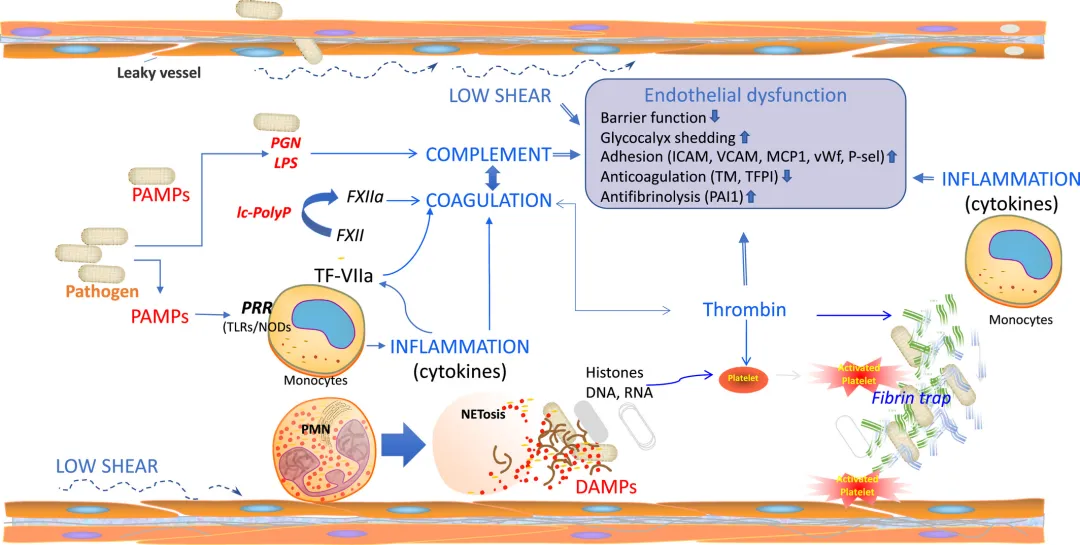
图2 脓毒症凝血病发病机制中血流动力学、炎症、补体和凝血的相互作用。
早期事件是对入侵病原体的直接反应。活菌或细菌衍生的病原体相关分子模式(PAMPS,如脂多糖 (LPS) 或肽聚糖 (PGN) )与模式识别受体(PRRs)相互作用,诱导炎症反应。细胞因子如 TNFα 和 IL1β 是促凝组织因子的强诱导剂,导致凝血酶生成和血小板活化,进而导致纤维蛋白沉积和微血管血栓/DIC 形成。凝血因子和血小板消耗可导致出血并发症。
总而言之,这些事件可导致早期器官衰竭和死亡。另一方面,病原体 PAMPs 可以触发补体激活,在此过程中产生的 C5a 过敏毒素是一种有效的白细胞趋化剂和激活剂。活化的中性粒细胞以富含 DNA 和组蛋白的细胞外陷阱 (NETs) 的形式释放其核内容物,这有助于病原体清除,但也是有效的血小板激活剂,并对宿主细胞具有细胞毒性。组蛋白和 DNA 可以作为损伤相关模式分子 (DAMPs),通过相同的传感器受体 PRR (TLRs/NODs) 受体发出信号,导致炎症、凝血和补体激活的进一步放大。此外,中性粒细胞释放的髓过氧化物酶有助于脓毒症相关的氧化应激和器官衰竭。总之,这些事件促进内皮功能障碍,其特征是屏障功能下降,糖萼脱落增多,白细胞粘附增加,抗凝和纤溶减少。跨内皮交换受内皮紧密和粘附连接、小窝和内皮糖萼(EG)控制。连接由位于 EC 裂隙之间的细胞间结合分子组成,包括紧密连接的咬合蛋白和闭合蛋白,以及粘附连接的钙粘蛋白和连环蛋白。A,在适当的剪应力作用下,覆盖健康内皮细胞的糖萼的组织。糖胺聚糖(GAGs)和核心蛋白的合成与其酶促降解之间存在平衡。脂筏携带 glypican-1 及其锚定的硫酸乙酰肝素(HS)到内皮细胞边界。携带 HS 和硫酸软骨素(CS)的 Syndecan-1 以及含有局部 glypican-1 和 HS 的小窝不移动。剪切应力诱导 HS 和 CS 的持续合成,由于 HS 和 CS 的均匀分布,内皮细胞的顶端形成并分布大量的长应力纤维,在那里它们稳定内皮小窝和 Syndecans-1。糖萼成分 HS、CS、glypican-1 和 syndecan-1 富集在顶端表面,且空间分布几乎均匀。VE-钙粘蛋白、连接蛋白、片状伪足和血小板内皮细胞粘附分子(PECAM)可稳定细胞间连接。内皮糖萼屏障的这种动态组织能够实现机械转导,调节毛细血管(内皮)通透性,并依赖于来自流动血液的适当剪切应力。
B,早期脓毒症期间糖萼组织的变化。PAMPs 和炎症产物介导糖萼—内皮细胞屏障 (EG/EC) 的破坏。随后的低血压和低剪切速率将剪切应力降低到非生理水平,导致糖萼脱落。透明质酸、HS 和 CS 的完整性被破坏。下层的 EC 失去保护,机械转导丢失,直接将 EC 暴露于非典型剪切应力下,损坏 EC。活性氧 (ROS) 进入 EC。白细胞更容易接触到 EC 附着和外渗。在这种 EG/EC 功能障碍的情况下,最重要的可能是 EC无法自我再生,在脓毒症的某个时间段,这种功能障碍是不可逆转的。总之,这篇综述指出了在脓毒症炎症早期就开始的 EG/EC 丧失的重要性,如果不加以纠正,将导致器官功能障碍和死亡。参考文献:Lupu F, Kinasewitz G, Dormer K. The role of endothelial shear stress on haemodynamics, inflammation, coagulation and glycocalyx during sepsis. J Cell Mol Med. 2020 Nov;24(21):12258-12271. doi: 10.1111/jcmm.15895. Epub 2020 Sep 19. PMID: 32951280; PMCID: PMC7687012.原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/32951280/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!



