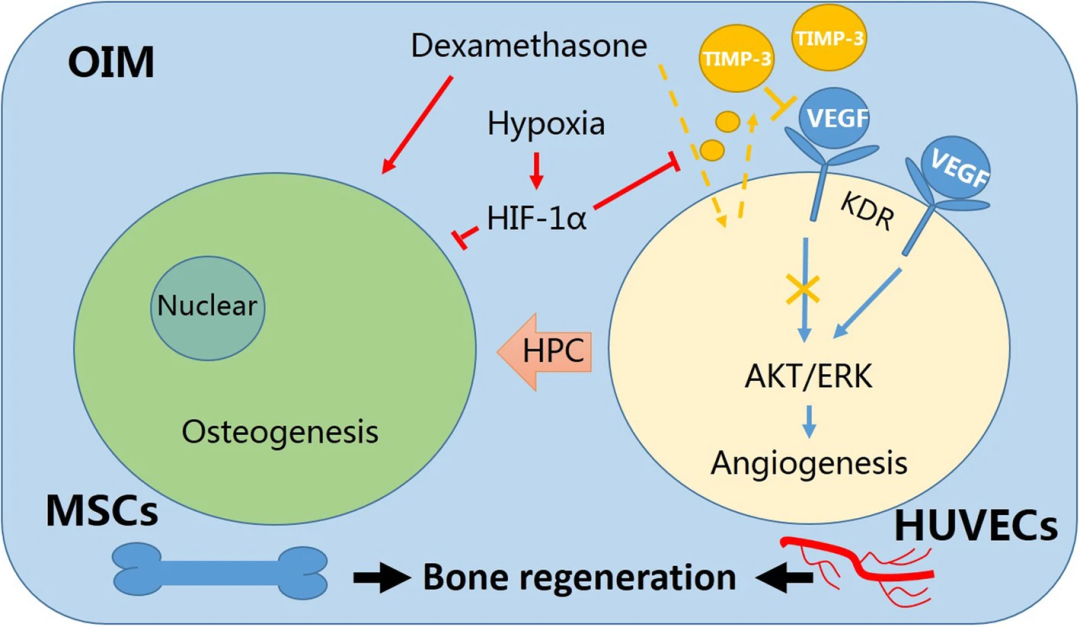
血管化性能不足是骨组织工程中的一个挑战,因为内部细胞由于缺乏营养供应而容易坏死。体外血管化主要基于人脐静脉内皮细胞(HUVECs)与间充质干细胞(MSCs)的共培养。在与生长培养基的共培养系统中观察到毛细血管状网络的形成。成骨环境与分化的 MSCs、HUVECs 和成骨诱导培养基(OIM)相关。研究表明,许多因素对 HUVECs 的血管生成有负面影响,包括分化的 MSCs 和 OIM 。然而,尚不清楚 OIM 中的哪些成分会抑制 HUVECs 的血管生成。地塞米松(DEXA)在 OIM 中是必需的,在成骨过程中起着不可或缺的作用。然而,已发现地塞米松在肿瘤微环境和胚胎发育中抑制血管的形成。此外,地塞米松通过下调 VEGF 分泌抑制血管生成来阻止肿瘤进展。然而,在 MSCs 和 HUVECs 的共培养系统中,地塞米松在 OIM 存在下如何在 HUVECs 血管生成中发挥作用仍有待探索。体内低氧有利于血管生成,从而促进骨修复。一方面,低氧可以调节糖酵解代谢(葡萄糖转运蛋白1/3、己糖激酶1/3、乳酸脱氢酶和丙酮酸激酶 M)在血管形成前介导细胞的移植后存活。另一方面,在低氧条件下表达的缺氧诱导因子(HIF-1α)可以通过增加大量促血管生成因子的表达来促进血管形成,从而影响氧气和营养物质向内部细胞的运输。因此,低氧似乎是一种在体外改善骨组织构造中血管生成的有效方法。为了在 OIM 共培养系统中改善 HUVECs 的血管生成,地塞米松在 OIM 共培养系统中抑制血管生成中的作用仍有待探索。氯化钴(CoCl 2)刺激的缺氧用于减轻地塞米松诱导的 HUVEC 血管生成的抑制。在生物反应器工程国家重点实验室(华东理工大学)的一项研究中揭示了共培养系统下 OIM 中 HUVECs 的行为和内部机制,为未来骨组织工程的血管预化提供了策略。
为了评估 HUVECs 对 MSCs 成骨分化的影响,MSCs 在 OIM 中与 HUVECs 一起培养 21 天,MSCs 单独培养为对照。进行茜素红 S 染色以表征 MSC 成骨。在第 7、14、21 天,共培养系统中出现的矿化结节比单一培养系统中的多。这表明 HUVECs 促进 OIM 中的 MSC 成骨。
然后实验观察共培养系统中的 HUVEC 血管生成情况。无论有没有 MSCs,HUVECs 都不能在 OIM 中形成毛细血管样结构。与 EGM 相比,OIM 中 HUVECs 的迁移和增殖能力受到显著抑制。为了确定 OIM 如何损害细胞增殖,使用流式细胞术检查 HUVECs 的细胞周期阶段。与 EGM 相比,OIM 处理后,G1 期 HUVECs 百分比增加,而 S 期细胞百分比减少。这表明 OIM 抑制 HUVEC 血管生成。
为了确定 OIM 中的哪些成分阻碍了 HUVEC 血管生成,将 OIM 中的成骨成分、地塞米松、β-gpd 和 L-维生素C 分别添加到 EGM 中。结果表明,在 Matrigel 管试验中,地塞米松显著抑制 HUVECs 形成毛细血管样结构,而且对 HUVECs 的增殖和迁移产生负面影响。随后,地塞米松组的促血管生成基因 VEGF 水平显著降低。抗血管生成基因 TIMP-3 的水平显著增加。这表明地塞米松抑制 HUVEC 血管生成。
已知 TIMP-3 可阻断血管内皮生长因子(VEGF)受体 KDR 信号通路,抑制 HUVEC 血管生成。为了确认TIMP-3 的基因表达结果,进行免疫印迹以测量 TIMP-3 和血管生成相关蛋白的表达。结果表明,地塞米松显著上调 TIMP-3 的蛋白表达,而在 OIM 存在下 TIMP-3 进一步上调。此外,作为 KDR 下游靶标且与 HUVECs 增殖和迁移相关的 AKT 和 ERK 的磷酸化水平也显著下调。
为了进一步验证 TIMP-3 是地塞米松诱导的血管生成抑制的重要介质,使用特异性 siRNA 敲低了 TIMP-3。沉默 TIMP-3 显著挽救了用地塞米松处理的 HUVECs 的毛细血管样结构。免疫结果显示,siTIMP-3 抑制 TIMP-3 的蛋白表达,而 VEGF-A 的表达没有变化(图4 d)。此外,恢复了 KDR、AKT 和 ERK 的磷酸化水平。这表明地塞米松通过上调 TIMP-3 表达来抑制 HUVEC 血管生成。
研究表明,低氧可以刺激血管生成。为了确定低氧是否可以减轻地塞米松对血管生成的抑制作用,CoCl 2 用于模拟缺氧。将 CoCl 2(50、100、150、200 或 250 μM)添加到 EGM 中以帮助 HUVECs 在存在地塞米松的情况下在 Matrigel 上形成毛细血管样结构。
结果表明,50 和 100 μM CoCl 2 都可以显著恢复 HUVECs 的毛细血管样结构。进一步的研究表明,HUVECs 的迁移能力在所有缺氧组中都有所提高,特别是在 50 和 100 μM CoCl 2处理组中。CCK-8 测定用于测量 HUVECs 的增殖能力。结果表明,用 50 和 100 μM CoCl 2处理组中的 HUVECs 增殖在 48 小时时显著改善(图5 d)。此外,q-PCR 结果显示 VEGF-A 的表达显著增加,而 TIMP-3 的表达降低。这表明缺氧挽救了地塞米松抑制的 HUVECs 的血管生成。
在下面的实验中探索了缺氧恢复地塞米松抑制的 HUVECs 毛细血管样结构的机制。首先,50 μM CoCl2 下检测血管生成相关蛋白的表达。数据显示 HIF-1α 的蛋白表达显著增加,TIMP-3 表达降低,VEGF-A 蛋白表达增加,KDR 及其下游靶点 AKT 和 ERK 的磷酸化水平显著恢复。
为了证实 HIF-1α 在缺氧条件下的血管修复中起关键作用,HIF-1α 被 siRNA 沉默。结果表明,缺氧可恢复地塞米松抑制的血管生成,但该过程因 HIF-1α 的沉默而中断。siRNA 介导的 HIF-1α 基因沉默显著降低了 HIF-1α 的蛋白质表达,而 TIMP-3 的表达增加(图6 d)。KDR 及其下游因子 AKT 和 ERK 的磷酸化水平也显著降低。这些结果表明,缺氧通过 HIF-1α 降低 TIMP-3 的表达,促进 HUVEC 血管生成。
最后,实验发现缺氧预处理的 HUVECs 可以促进 MSCs 在第 7 天表达成骨标志物 ALP,并在第 14 天和第 21 天积累矿化结节。Matrigel 管测定结果显示,在 OIM 存在下,缺氧预处理的 HUVECs 部分恢复了共培养系统中的毛细血管样结构,这表明促进了成骨和血管生成。
这些结果揭示了 TIMP-3 在血管生成中的关键作用,并在骨组织工程中发现了一种缺氧策略用于血管形成。缺氧预处理的 HUVECs 和 MSCs 的共培养在 OIM 中显示出强大的血管生成和成骨作用,这对未来骨组织工程中的血管形成具有重要意义。参考文献:Chai M, Gu C, Shen Q, Liu J, Zhou Y, Jin Z, Xiong W, Zhou Y, Tan W. Hypoxia alleviates dexamethasone-induced inhibition of angiogenesis in cocultures of HUVECs and rBMSCs via HIF-1α. Stem Cell Res Ther. 2020 Aug 6;11(1):343. doi: 10.1186/s13287-020-01853-x. PMID: 32762747; PMCID: PMC7409505.原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/32762747/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。关注公众号Naturethink了解更多仿生培养知识!