用于动脉粥样硬化和抗动脉粥样硬化的剪切应力信号的内皮机械传感器
源自中胚层的血管内皮细胞(ECs)形成覆盖在血管内表面的单层鳞状细胞。除了受到来自细胞外基质(ECM)和血液的化学信号的调节外,ECs 还直接面对复杂的血流动力学环境。这些物理输入被转化为生化信号,决定了细胞行为和目的的多个方面,包括生长、分化、迁移、粘附、死亡和存活。
机械传感器是对机械环境变化的初始响应者,其中绝大多数位于质膜上。物理力影响质膜流动性和质膜上蛋白质复合物的变化,伴随着改变细胞间连接、细胞-ECM 粘附、细胞骨架的变形,从而形成特定表型的转录反应。在施加在 ECs 上的各种力中,定义为血流施加的切向摩擦力的剪切应力(SS)已被广泛研究,包括机械感应、机械转导以及相应的表型。
然而,确定动脉粥样硬化倾向和动脉粥样硬化保护表型的精确机械传感器和信号通路仍不清楚。此外,值得一提的是,一些已建立的抗动脉粥样硬化 SS 机械传感器,例如内皮糖萼,可能会被动脉粥样硬化倾向的 SS 破坏。因此,南京医科大学第一附属医院心血管内科的课题组概述了当前关于 ECs 中 SS 信号的机械传感器的研究进展。

整合素
整合素是跨膜蛋白受体家族,它结合 ECM 中的粘附分子并通过连接蛋白连接到细胞内细胞骨架,从而建立细胞内外结构的连续性。它们是由两个亚基 α 和 β 组成的跨膜粘附蛋白。
Sun 等人表明,振荡剪切应力(OSS,0.5 ± 4 dynes/cm2,2 h)显著提高了脂筏中总的和活化的整合素 α5 的水平。动脉粥样硬化易发区的 EC 功能障碍依赖性于整合素 α5。此外,层流SS(12 dynes/cm2,5 min)快速激活整合素 αvβ3 以及整合素 β3,并促进整合素-Gα13 相互作用,从而在体内和体外抑制 RhoA-YAP 磷酸化。OSS 还通过 ECs 中的 CCN1-α6β1 通路促进动脉粥样硬化表型。先前的一项研究表明,整合素 αvβ3 通过层状 SS 介导 Rho 依赖性的细胞骨架排列。
细胞骨架
细胞骨架是指蛋白质纤维骨架,由微管(MTs)、微丝(MFs)和中间丝(IFs)组成。它与细胞形态和细胞运动的变化有关。
层流 SS 通过调节应力纤维的组装和排列来诱导 ECs 的伸长和取向。Avari 等人使用 GFP-波形蛋白融合蛋白观察暴露于流体层流SS(12 dynes/cm2)的活 ECs 中 IFs 的快速变形。在静态条件下,F-肌动蛋白短而薄且方向随机,而 F-肌动蛋白链环绕在细胞边缘。在动脉粥样硬化倾向条件下(1.13±0.10 dynes/cm2,24 h),ECs 呈现整体随机F-肌动蛋白极性,外围肌动蛋白链消失。在动脉粥样硬化保护条件下(11.5±0.9 dynes/cm2,24 h),F-肌动蛋白与血流方向一致,细胞内布满更致密、更粗的肌动蛋白束。
小窝
小窝或细胞质膜微囊(Caveolae),直径 50~100nm,是细胞膜内陷形成的烧瓶状质膜微区,主要由胆固醇、鞘磷脂、蛋白质组成。小窝蛋白-1(Caveolin-1)是其主要的蛋白成分。
小窝的亚细胞分布和周转由 SS 动态调节。在静态条件下,据报道 Cav-1 主要位于细胞边界附近。然而,Cav-1 在层流 SS 暴露(15 dynes/cm2,24 h)后向细胞中间和顶端堆叠迁移。Wang 等人表明 OSS(4 dynes/cm2,30 min)导致 Cav-1 在 tyrosine-14 上的磷酸化。另一组发现层流 SS(10 dynes/cm2,5 min)刺激 Cav-1 磷酸化(pY14),这取决于 Src 家族激酶(SFK)活性和整合素的激活。层流 SS(15 dynes/cm2,秒)在小窝处引起三磷酸腺苷(ATP)释放,随后在 ECs 的相同位置触发 Ca2+ 通量。
离子通道
几个离子通道是 SS 响应的,它们的电流可以通过全细胞膜片钳法确定。应用 LSS(0.5-3.5 dynes/cm2,秒)后,流出氯化物的通道导致 EC 膜去极化,而流入钾离子的流动敏感通道介导EC 膜超极化。
最近,跨膜蛋白 Piezo1 已被确定为机械激活离子通道的重要组成部分。Piezo1 介导层流 SS 诱导的 Ca2+ 内流,还调节血管生成、NO 产生、血管张力和血压。层流 SS(15 dynes/cm2)诱发了前顶端片状伪足处的 Piezo1 积累。内皮 Piezo1 是启动层流诱导的 ATP 释放和血管舒张(15 dynes/cm2)所必需的,从而控制血压。HSS 诱导的单核细胞活化依赖于 Piezo1,通过导管主动脉瓣植入(TAVI)减少 SS 导致的单核细胞活化下调。
G 蛋白和 GPCRs
已经表明,即使在没有另一个潜在的机械传感器的情况下,层流 SS(30 dynes/cm2,1 min)在无蛋白质受体区域激活和重组纯化的 G 蛋白脂质体,这表明 G 蛋白是一种机械传感器。
HSS(300 dynes/cm2, 2 min)被发现在 GPCRs 中引起配体无关的构象变化。Zeng 等人表明,CXCR1 和 CXCR2,众所周知的 GPCRs,介导了层流 SS 诱导的 EC 迁移。Gαq/11 和 PECAM-1 共定位于小鼠主动脉动脉粥样硬化保护区域的细胞-细胞连接处。有趣的是,在动脉粥样硬化易发区和 PECAM-1 敲除小鼠的整个动脉中,Gαq/11 均缺失,这表明 Gαq/11-PECAM-1 复合物是血管疾病的关键介质。
糖萼
由蛋白聚糖(PGs)及其相关的糖胺聚糖(GAG)侧链组成的内皮细胞糖萼(EG)可以通过钌红染色来识别。
暴露于层流 SS(15 dynes/cm2)24 小时后,糖萼的厚度增加。Yao 等人表明,肝素酶去除糖萼可防止 HSS 诱导的细胞重新定向并减弱 HSS 介导的细胞增殖。Dragovich 等人证明了响应层状 SS 的快速 Ca2+ 内流和 NO 产生取决于 EG。最后,EG 不同程度地介导了动脉粥样硬化保护和动脉粥样硬化倾向性 SS 的作用,因为相比于动脉粥样硬化保护性SS的作用,动脉粥样硬化性 SS 干扰了 EG 的表达。
初级纤毛
纤毛结构大体上可以分为三部分:轴丝、纤毛基质和纤毛膜。纤毛大体可分为两种型态:一种称为运动纤毛,其轴丝的主体骨架为“9+2”微管结构;另一种是初级纤毛,大多为“9+0”结构,一般用作感应细胞器。
初级纤毛在体内低流动和振荡流动区域更加丰富和更长。然而,在层流 SS(15 dynes/cm2,1-2 h)下,它们几乎无法被检测到并且变得更短和更容易被拆解。经受层状SS(15 dynes/cm2,5 h)处理的胚胎动脉中的非纤毛细胞的KLF2表达明显低于胚胎心脏纤毛细胞。纤毛多囊蛋白2(PC-2)的正确表达和定位是NO 生物合成响应层流 SS(7 dynes/cm2)所必需的。
丛状蛋白 D1
Plexin D1(PLXND1)是跨膜蛋白丛蛋白的一个亚家族,是信号素家族中一种关键的 Ca2+ 依赖性细胞表面受体,具有多种结构。
最近,Mehta 等人发现 PLXND1 是一种直接的机械传感器。PLXND1 与 neuropilin-1 和 VEGFR2 形成机械复合物以响应 SS(12 dynes/cm2,2 min),并且该机械复合物位于连接复合物和整合素激活的上游。敲除 PLXND1 表达减弱了层流 SS(12 dynes/cm2,10 min)下的早期反应,例如关键信号传导介质 Akt、ERK1/2 和 eNOS 的磷酸化。
其他可能的机械传感器
酪氨酸激酶受体是剪切应力传感和转导的重要参与者,尤其是 VEGFR-2。此外,Tie1/Tie2 受体系统在 ECs 的稳态中起关键作用。Tie2 的总量和磷酸化水平在层流 SS(6 dynes/cm2)下增加。Idowu 等人指出 Tie2 以 GATA3 依赖性方式控制血管屏障功能。值得注意的是,Tie1 表达的快速下调是由该分子的快速裂解导致的,它对层流 SS 变化敏感。裂解的 Tie1 45 kDa 内结构域与 Tie2 的结合可能是 ECs 不稳定所必需的。相比之下,Tie1 启动子活性被扰动流上调。
最近有人提出核受体 YAP 和 TAZ 是新型的核中继传感器和机械信号的介质。YAP/TAZ 活性受 ECM 硬度和细胞几何形状的调节,这需要 Rho 活性和肌动球蛋白细胞骨架。层流 SS(15 dynes/cm2,18 h)降低了血管紧张素转换酶(ACE)的表达,因为这种反应需要细胞外和细胞内结构域以及 ACE Ser1270,Barauna 等人提出,ACE 细胞外结构域充当机械传感器,而细胞质结构域转导下游细胞内 JNK 信号传导。

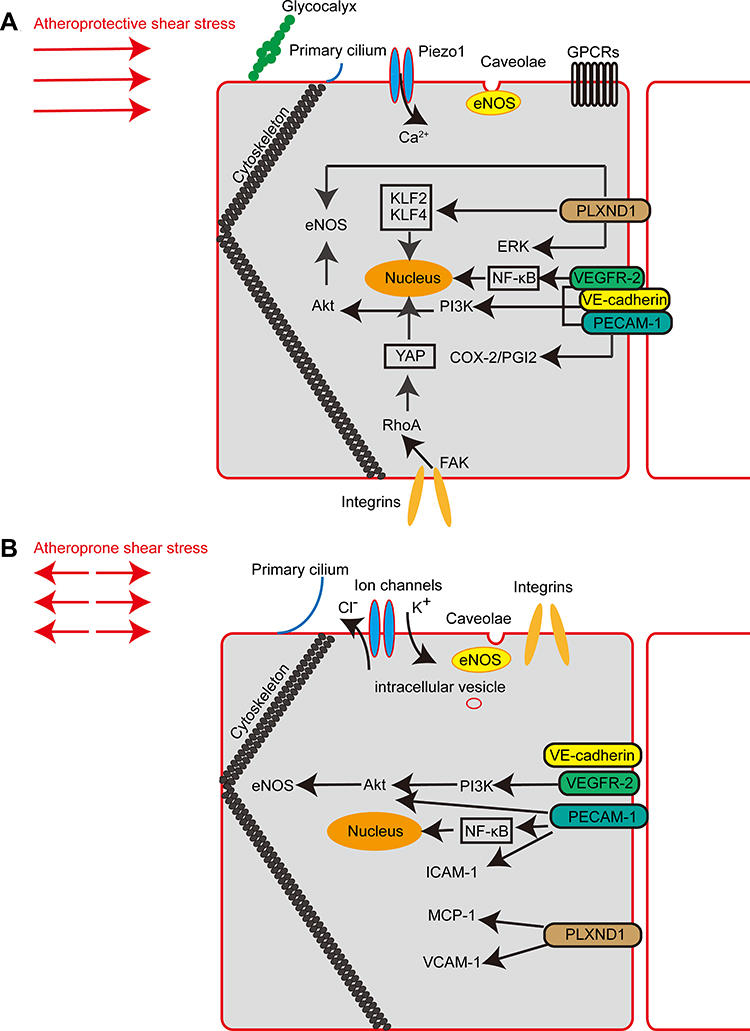
图1 参与内皮细胞机械转导的主要机械传感器和信号通路。
(A)显示了动脉粥样硬化保护性剪切应力中的内皮机械传感器和信号通路。
(B)显示了动脉粥样硬化倾向性剪切应力中的内皮机械传感器和信号通路。
目前,随着多层次和多维策略被应用于探索流量响应,正在发现更多的潜在机械敏感基因。其他机械传感器也可能与其他因素一起参与动脉粥样硬化的不同阶段。未来,这还需要进一步的研究。
参考文献:Li H, Zhou WY, Xia YY, Zhang JX. Endothelial Mechanosensors for Atheroprone and Atheroprotective Shear Stress Signals. J Inflamm Res. 2022 Mar 11;15:1771-1783. doi: 10.2147/JIR.S355158. PMID: 35300215; PMCID: PMC8923682.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35300215/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。微信搜索公众号“Naturethink”,一起了解更多流体力学刺激细胞培养相关知识吧!