机械拉伸通过上调BMP-2/6异源二聚体和激活P38和SMAD1/5/8信号通路诱导人纤维环细胞的成骨
椎间盘退行性病变(DDD)是腰痛的重要病因。DDD的发病机制复杂,包括机械负荷过大、创伤、炎症、遗传、衰老、肥胖、营养不良等。椎间盘(IVD)纤维环(AF)的物理损伤是脊柱退行性改变的重要原因。过度的机械拉伸会改变AF细胞的数量和表型,从而降低AF的弹性,导致IVD进一步损伤和退化。此外,AF细胞具有祖细胞的特性,可以在体外和体内分化为软骨细胞和成骨细胞。因此,研究AF细胞上成骨的信号通路对于阐明DDD的发病机制非常重要。
BMPs(人骨形态发生蛋白)是转化生长因子-β(TGF-β)超家族的成员,具有诱导干细胞分化为成骨细胞并促进骨形成的潜力。BMP-2及其I型和II型受体的表达已在小鼠IVD的纤维细胞中观察到。BMP-2/4及其I型和II型受体在50周龄衰老加速小鼠AF内的纤维软骨细胞中强烈表达,因此似乎与IVD的变性有关。到目前为止,许多研究已经使用包含两个BMP基因的异源二聚体配体来阐明BMP异源二聚体的广泛生物学作用,并且不同BMP配体的共表达可导致异源二聚体配体的形成。然而,BMP-2/6异源二聚体在IVD变性的发病机制中的作用尚未得到很好的研究。
因此,国立嘉义大学生化科学与技术系及食品科学系、成功大学医院附设医院骨科的一项联合研究的目的是确定BMP-2/6异源二聚体在IVD中的作用,以及IVD中机械拉伸与成骨反应之间的因果关系以及IVD变性的信号通路。

HCS 上调人 AF 细胞中的成骨基因表达
为了测试循环拉伸是否可以启动与IVD成骨相关的基因表达,对人AF细胞进行培养并接受循环拉伸方案,其中轻度循环拉伸(LCS,5%)或高度循环拉伸(HCS,15%)持续不同时间(图1)。实验检测了HCS处理是否能够在AF细胞中诱导Runx2、osterix和OPN表达。结果表明,与对照和LCS处理的细胞相比,受HCS刺激4 h的AF细胞显著诱导Runx2、osterix、OPN 的mRNA(图1 A)和蛋白质(图1 B)表达增加。此外,Runx2、osterix、OPN 的mRNA(图1 C)和蛋白质(图1 D)水平测定的时间过程显示,在HCS处理的AF细胞中,1小时内升高,并持续8小时。
Runx2是成骨基因表达的关键转录因子,因此研究了Runx2是否可以调节HCS对AF细胞中osterix和OPN表达的影响。结果表明,用 Runx2 特异性 siRNA 预处理细胞可显著抑制 HCS 诱导的 osterix 和 OPN 的mRNA 和蛋白质在AF细胞中的表达,这说明Runx2 参与 HCS 诱导的成骨。

图1 HCS 上调人 AF 细胞中的成骨基因表达。
BMP-2/6 异源二聚体介导拉伸诱导的成骨基因表达
BMPs是成骨分化的主要调节因子。因此,实验确定了HCS处理引发的成骨基因表达是否会通过上调人AF细胞中的BMPs而产生。结果表明,与对照组相比,经HCS处理的AF细胞中BMP-2和BMP-6的mRNA表达显著增加(图2 A)。此外,用针对BMP-2(Ab-BMP-2)和BMP-6(Ab-BMP-6)的中和抗体预处理的细胞显著抑制了HCS对AF细胞中Runx2、osterix和OPN基因(图2 B)和蛋白质(图2 C)表达的上调作用。在重组蛋白实验中,BMP-2和BMP-6均不能上调Runx2和osterix的基因和蛋白表达,而BMP-2/6在相同浓度下诱导Runx2和 osterix 的显著表达。这些结果可推测,当BMP-2或BMP-6的浓度不足以诱导基因和蛋白质表达时,BMP-2/6可有效诱导Runx2和osterix表达。
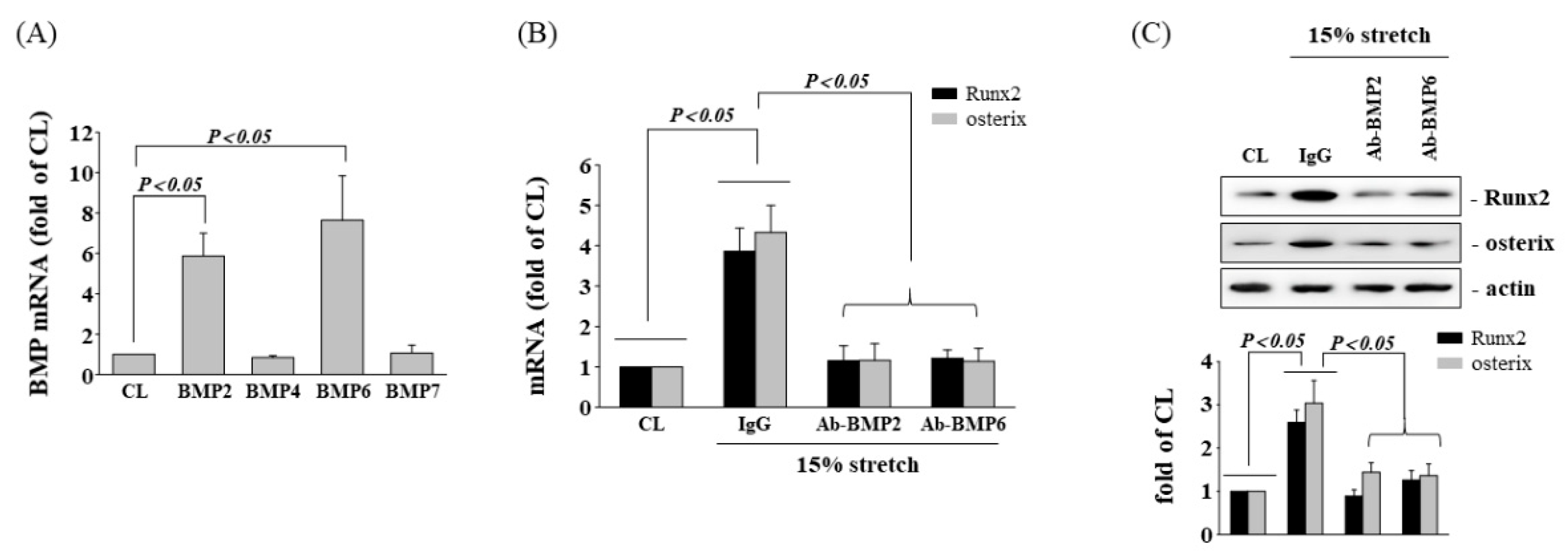
图2 BMP-2/6异源二聚体介导拉伸拉伸诱导的成骨基因表达。
HCS 诱导的 Runx2 表达依赖于 p38 MAPK
MAPK通路已被证明可以调节许多细胞过程,包括成骨基因表达。为了研究MAPKs参与HCS诱导调节Runx2表达的情况,在HCS刺激之前和期间用MAPKs的特异性抑制剂(用于ERK的PD98059,用于JNK的SP600125,用于p38的SB203580)处理人AF细胞1小时。结果发现,SB203580可显著抑制HCS诱导的Runx2 基因(图3 A)和蛋白质(图3 B)表达。HCS诱导后AF细胞中p38的磷酸化迅速增加,在1-2小时达到最大水平(图3 C)。此外,与对照和LCS处理的细胞相比,受HCS刺激1小时的细胞显著诱导AF细胞中的p38磷酸化。
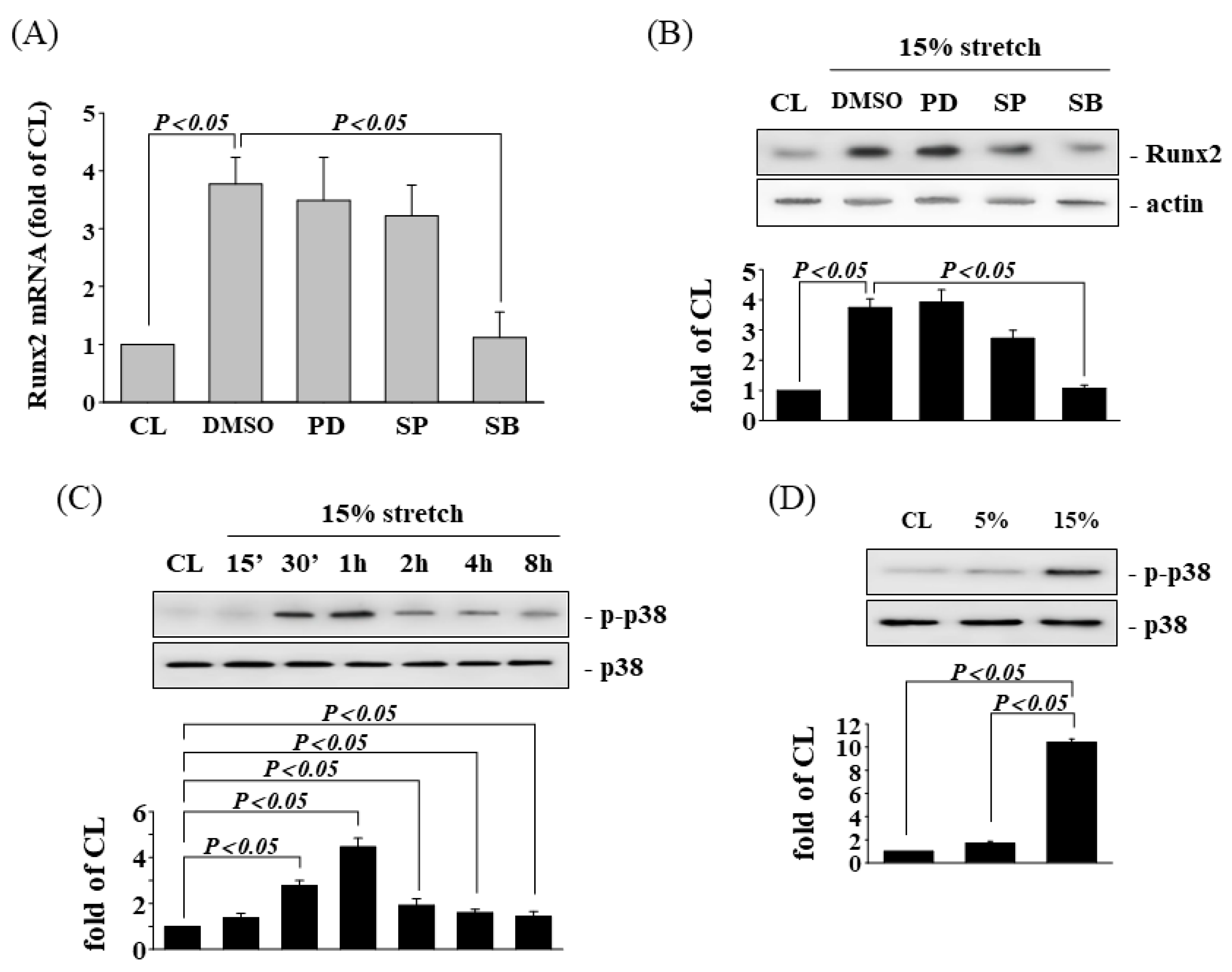
图3 HCS 诱导的 Runx2 表达依赖于 p38 MAPK。
SAMD1/5/8 参与循环拉伸诱导的 Runx2 表达
将BMP信号传输到细胞核所需的SMAD蛋白已被证明可以诱导成骨基因表达。实验研究了SMAD1/5/8是否可以调节HCS诱导的人AF细胞中的Runx2表达。结果表明,与对照相比,HCS处理的AF细胞的在1小时内显著诱导SMAD1/5/8 的磷酸化,并持续8小时。与对照和LCS处理的细胞相比,由HCS刺激4小时的人AF细胞显著诱导SMAD1/5/8的磷酸化。用SMAD1特异性siRNA预处理细胞显著抑制HCS处理诱导的Runx2 mRNA 和蛋白质表达。
抑制 ALK3 受体降低循环拉伸诱导的成骨基因表达
据报道,BMP-2/6异源二聚体可以结合和激活ALK3受体,并进一步影响宿主细胞基因的表达。为了评估ALK3在HCS刺激的AF细胞成骨表型中的作用,实验评估了ALK3-siRNA和抑制剂(LDN)对HCS诱导的人AF细胞中Runx2和osterix表达的影响。结果表明,HCS诱导的Runx2和osterix的mRNA表达通过ALK3-siRNA或LDN处理显著降低。此外,HCS诱导的Runx2和osterix的蛋白表达在用LDN预处理的AF细胞中也被抑制。此外,在用LDN预处理的细胞中,由rhBMP-2/6 异源二聚体刺激的Runx6 mRNA表达在AF细胞中受到显著抑制。
IVD 损伤患者的成骨基因表达
图4 表现为IVD损伤患者手术切除组织中的成骨基因表达。退行性IVD和LF组织均表现出成骨表型,这通过Runx2(图4 A)、osterix(图4 B)和 OPN (图4 C)的mRNA表达的增加证实。成骨基因在AF组织中的表达水平高于黄韧带(LF)组织。
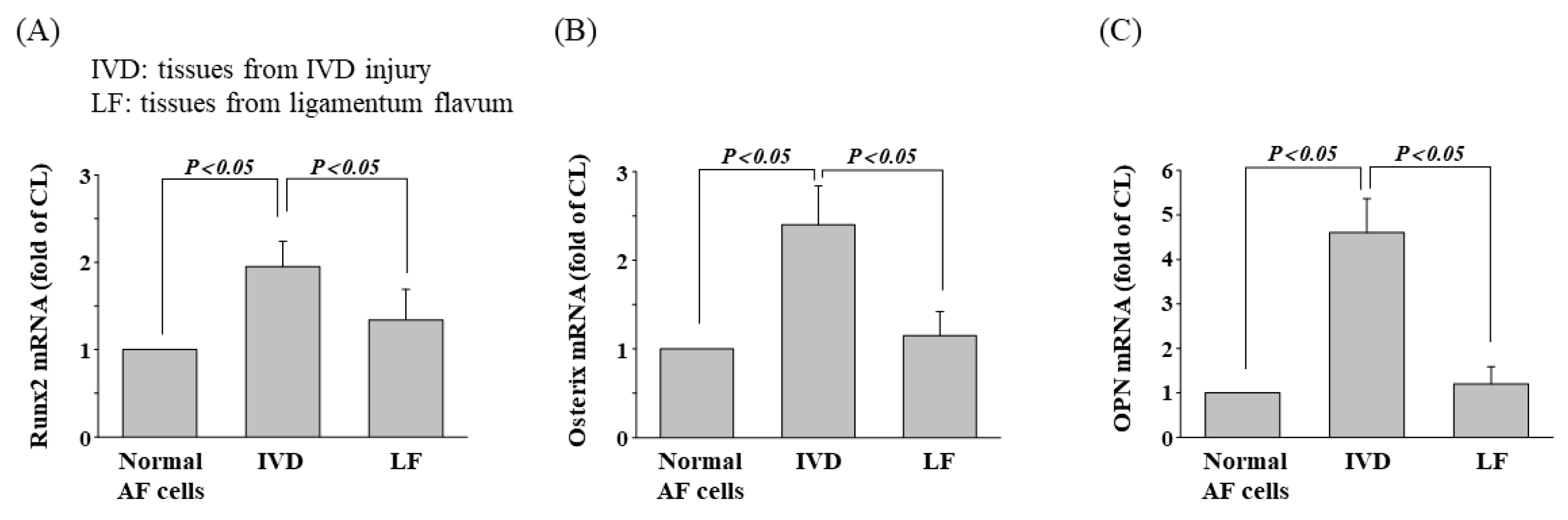
图4 IVD 损伤患者的成骨基因表达。
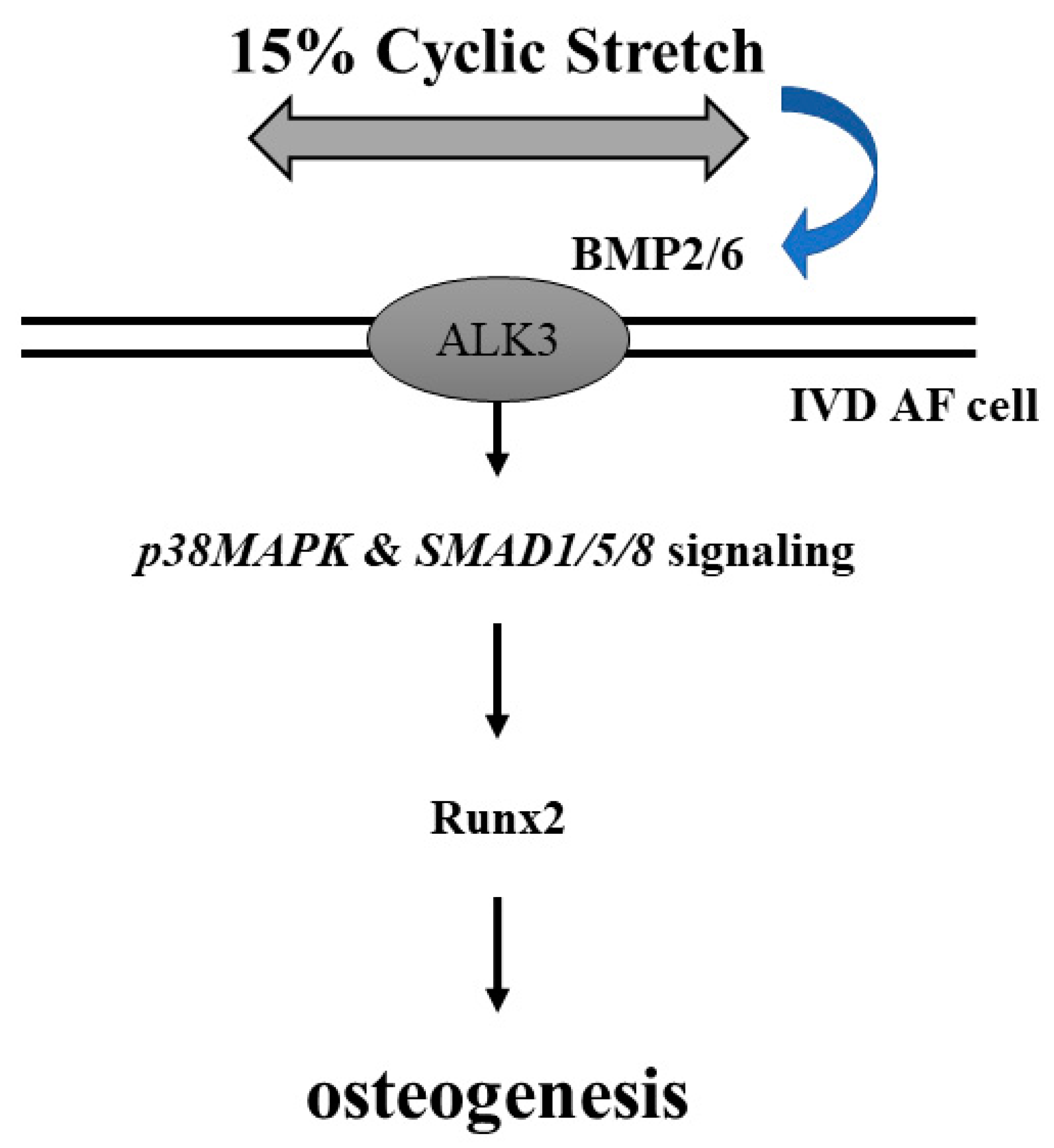
图5 影响人 AF 细胞中 15% 循环拉伸诱导的 BMP-2/6 表达和随后的成骨调控的可能机制的示意图。
总之,该研究结果提供了有关HCS诱导人AF细胞成骨基因表达的机制的信息。研究发现,用HCS刺激人AF细胞导致BMP-2/6异二聚体介导的信号通路的激活。抑制ALK3活性可能是控制AF细胞成骨的有效方法。HCS还诱导p38 MAPK和SMAD1/5/8信号通路的激活,并最终增强Runx2和osterix在人AF细胞中的表达。此外,还发现人类退行性IVD组织比LF组织具有更高的成骨基因表达。这些发现为人类AF细胞中机械拉伸和细胞信号传导相互作用的机制提供了见解,这可能参与DDD的进展,并可用于DDD患者IVD变性的未来治疗干预。
参考文献:Chen CN, Chang HI, Yen CK, Liu WL, Huang KY. Mechanical Stretch Induced Osteogenesis on Human Annulus Fibrosus Cells through Upregulation of BMP-2/6 Heterodimer and Activation of P38 and SMAD1/5/8 Signaling Pathways. Cells. 2022 Aug 20;11(16):2600. doi: 10.3390/cells11162600. PMID: 36010676; PMCID: PMC9406707.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36010676/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。