压力负荷通过 ERK1/2–Dicer 信号通路诱导人肝细胞系 L02 细胞中的 DNA 损伤
肝细胞癌(HCC)主要发生在肝硬化中,发病率和死亡率都很高。肝脏力学的变化(固体压力、间质液压力和细胞外基质硬度)与肝细胞癌的发展有关。越来越多的研究表明,机械力可以调节肝细胞的生物学行为并导致细胞的恶性转化。因此,探索机械力对肝细胞的影响可能有助于发现预防 HCC 发展的新干预措施。
基因组不稳定性是大多数癌症的特征。最近的一些研究发现,机械变化会导致细胞中的DNA损伤,如果这种损伤不被修复,就会影响基因组的稳定性,增加正常细胞发生癌变的可能性。然而,机械因素对肝细胞 DNA 损伤的影响以及所涉及的分子机制尚不清楚。
Dicer 是一种 III 型细胞质内切酶,可调节 DNA 损伤反应(DDR),该功能不依赖于 microRNA。快速分裂的细胞依靠 Dicer 来帮助它们修复由基因复制错误引起的 DNA 损伤。同时,据报道,细胞外信号调节激酶1/2(ERK1/2)参与 DDR 信号通路并调节 Dicer 表达。ERK1/2 具有易位至细胞核和磷酸化转录因子的能力,在 DDR 期间激活 ERK 信号通路有助于激活 DDR 检查点,从而抑制胞质分裂。此外,已经表明机械因素可以激活 ERK1/2,从而调节细胞行为。因此,假设机械力通过影响 ERK1/2 的激活来调控 Dicer。
在这项研究中,重庆大学生物工程学院的课题组研究了正常肝细胞对应激反应的 DNA 损伤,结果进一步揭示了可能涉及的分子机制。研究发现更高的压力驱动增加了 Dicer 的表达水平,以及 DNA 损伤的积累,可能是通过 ERK1/2-Dicer 信号通路。

压力会加重肝细胞中的 DNA 损伤并激活 DDR 通路
研究发现,机械刺激可导致某些类型细胞的 DNA 损伤,但尚未明确证明压力下肝细胞的 DNA 损伤。为了研究压力对肝细胞 DNA 损伤的影响,研究人员设计并制造了一种体外压力加载装置(图1 A),用于模拟正常门静脉压力(5 mmHg)和门静脉高压(20 mmHg 和 40 mmHg)。实验发现,与5 mmHg相比,两次高压下肝细胞的拖尾现象更为明显,DNA损伤指标Tail DNA%和OTM值显著增加(图1 B)。结果表明,随着压力的增加,肝细胞中的DNA损伤程度显著增加。
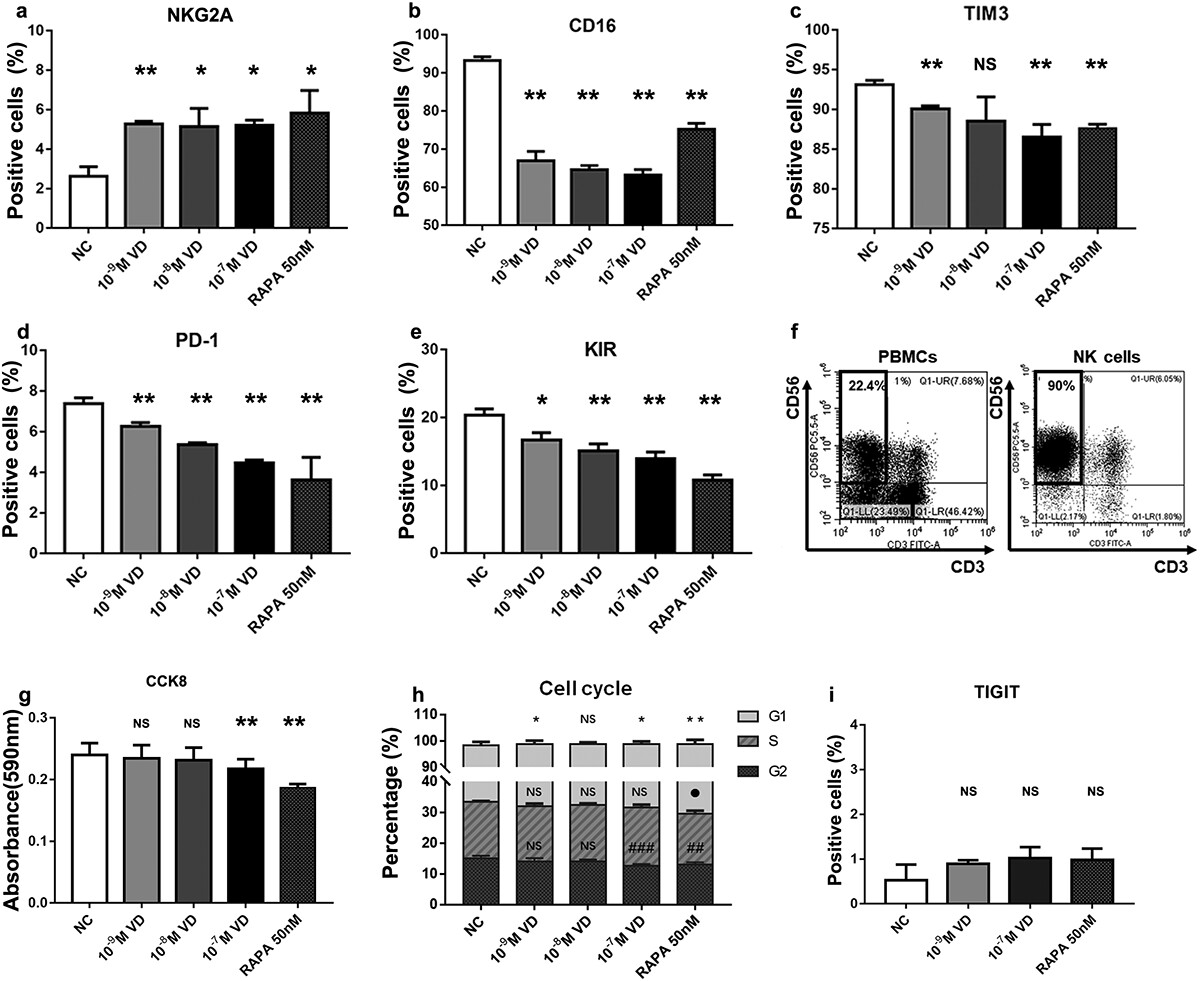
图1 压力负荷加重肝细胞中的DNA损伤。(A)压力加载装置中压力和压力随时间变化的实验装置的示意图。(B)使用彗星测定法检查在不同压力水平(5,20,40mmHg)下培养48小时的肝细胞中的DNA损伤。
经历 DNA 损伤的细胞启动 DDR 信号通路以响应 DNA 损伤,该通路可通过细胞周期停滞、激活 DNA 修复通路和诱导细胞凋亡来响应 DNA 损伤。首先,用蛋白质印迹检查 DNA 修复蛋白 γ-H2AX 和 53BP1 的表达变化。与 5 mmHg 相比,在高压下培养的肝细胞中 γ-H2AX 和 53BP1 的蛋白表达水平显著增加(图2 A)。压力改变了不同细胞周期阶段肝细胞的百分比。在压力下孵育 48 小时后,S 期细胞的百分比分别为 22.6%、37.4% 和 46%,与 5 mmHg 的压力相比,更高的压力显著增加了 S 期细胞的百分比(图2 B)。总之,这些结果表明,较高的压力会诱导肝细胞中的 DNA 损伤,并且细胞通过增加 DNA 修复蛋白的表达和阻止细胞周期来响应这种变化。
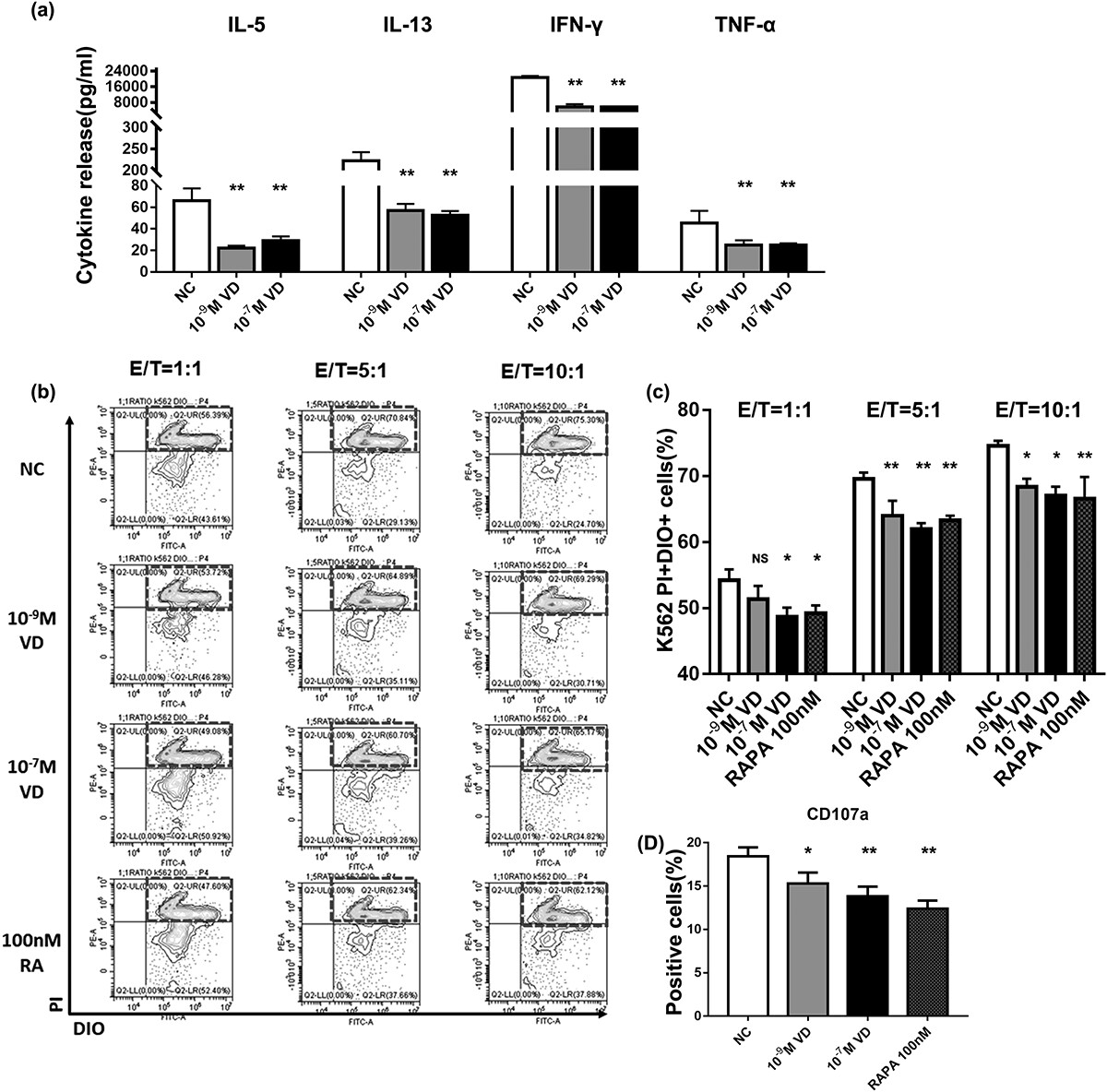
图2 压力负荷导致肝细胞中DNA修复蛋白的表达增加和细胞周期停滞。(A)用蛋白质印迹检查肝细胞中的DNA修复蛋白并定量检测γ-H2AX和53BP表达水平。细胞暴露于压力下48小时。(B)在压力加载48小时后使用流式细胞术分析细胞周期分布。
Dicer 表达的下调通过减弱 DDR 通路反应加剧了压力诱导的 DNA 损伤
在存在外源性 DNA 损伤的情况下,Dicer 会产生 DDR 所需的小型非编码 RNA 。为了测试 Dicer 是否受压力调节,实验检查了 Dicer 在用不同压力水平处理的肝细胞中的表达。用蛋白质印迹测量 Dicer 的表达水平,发现随着压力的增加而上调(图3 A)。为了确定 Dicer 对应激诱导的 DNA 损伤的影响,使用特异性 siRNA 敲低 Dicer 并使用蛋白质印迹分析检测 Dicer 的表达水平。结果表明,Dicer的表达受到显著抑制(图3 B)。此外,Dicer 的敲低导致压力刺激的肝细胞中的 DNA 损伤增强(图3 C)。
同时,检测了 γ-H2AX 和 53BP1 的表达水平以及 Dicer 敲低后细胞周期分布的变化。结果发现,在压力作用下,Dicer 敲低后γ-H2AX 和 53BP1 在肝细胞中的表达水平显著下调,并且 Dicer 在肝细胞中的敲低导致 S 期细胞百分比降低和G1 期细胞数量增加。总体而言,Dicer 可能通过抑制 DNA 损伤修复和影响细胞周期进程,导致压力下肝细胞中的 DNA 损伤增加。
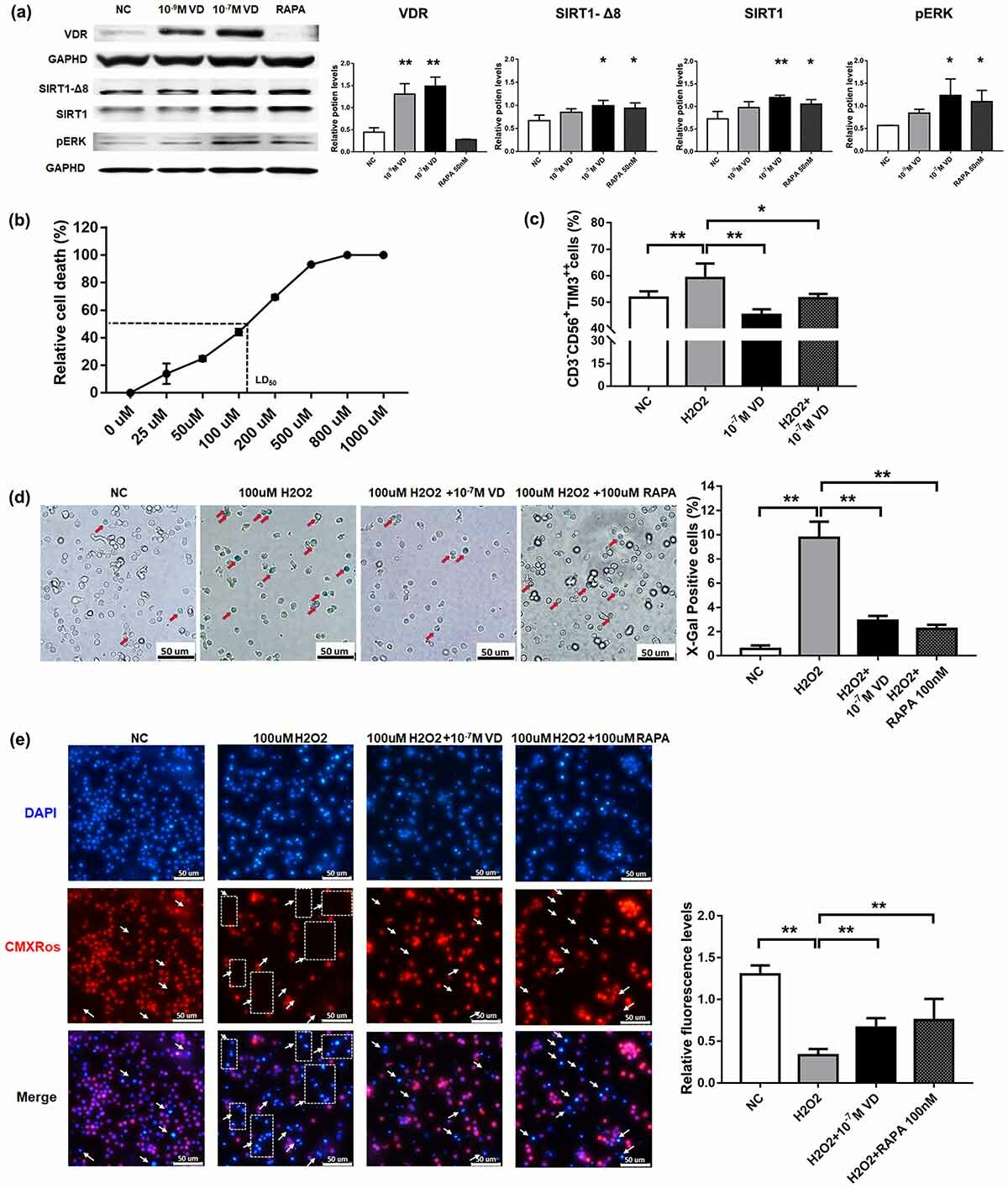
图3 降低的Dicer 表达水平增强了肝细胞中压力诱导的DNA损伤。(A)用不同的压力水平(5,20,40mmHg)处理肝细胞48小时。蛋白质印迹分析显示Dicer的蛋白质水平。(B)将细胞用阴性对照siRNA或Dicer siRNA转染48小时。蛋白质印迹显示Dicer 敲低后 Dicer 的蛋白质水平。(C)用彗星测定法检查在不同压力水平(5,20,40mmHg)下培养48小时的肝细胞的DNA损伤。
ERK1/2 信号分子在压力负荷下调节肝细胞中的 Dicer 表达水平和 DNA 损伤
ERK1/2 调节多种细胞生物学过程以响应正常和病理条件下的应激,例如增殖、分化、凋亡和关键信号通路。据报道,磷酸化 ERK1/2(p-ERK1/2)会因机械刺激而发生改变。此外,p-ERK1/2 调节 Dicer的转录水平。因此,研究推测压力可能通过 ERK1/2 信号分子影响 Dicer 的表达水平。
首先,通过蛋白质印迹检测了 ERK1/2 的表达及其磷酸化水平,发现 ERK1/2 的磷酸化水平在较高的压力下显著增加(图4 A)。然后,为了探索 ERK1/2 信号分子对 Dicer 表达的影响,用 MEK1/2 抑制剂(U0126)处理不同应激负荷条件下的肝细胞。在 U0126 处理后 p-ERK1/2 的表达被显著抑制,并且 U0126 降低了较高压力诱导的 Dicer 表达水平(图4 B)。后来,通过彗星试验的结果发现,U0126 处理加剧了在压力下培养的肝细胞中的 DNA 损伤(图4 C)。
此外,检查了 U0126 处理后 γ-H2AX 和 53BP1 的表达水平和细胞周期分布的变化。在用 U0126 处理的压力负荷肝细胞中,γ-H2AX 和 53BP1 的表达显著下调。细胞周期各期的分布比例发生显著变化,表明抑制ERK1/2激活降低了S期细胞的比例,增加了G1期细胞的数量。
这些结果表明,应激诱导的 Dicer 表达受 ERK1/2 激活的影响。此外,肝细胞压力诱导的 DNA 损伤程度受 DNA 修复蛋白的募集和通过 ERK1/2-Dicer 信号通路的细胞周期停滞的调节。
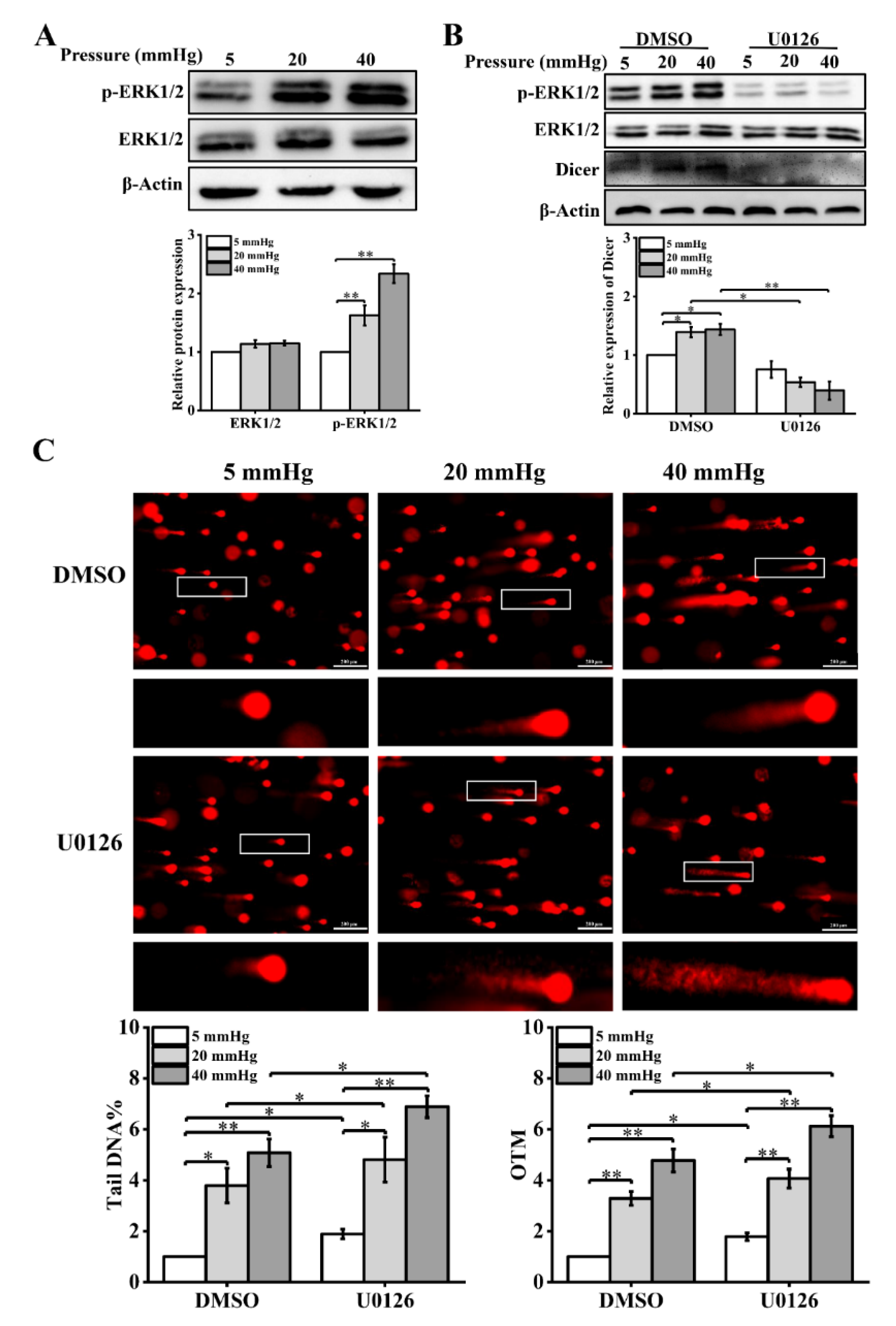
图4 压力激活ERK1/2,U0126处理导致肝细胞在压力下DNA损伤增加。(A)蛋白质印迹显示用压力处理48小时的肝细胞中p-ERK1/2和ERK1/2的蛋白质水平。(B)蛋白质印迹显示用U0126(10μM)处理的肝细胞中p-ERK1/2,ERK1/2和Dicer 的蛋白质水平。(C)用彗星测定法检查在不同压力水平(5,20,40mmHg)下培养48小时的U0126处理的肝细胞的DNA损伤。
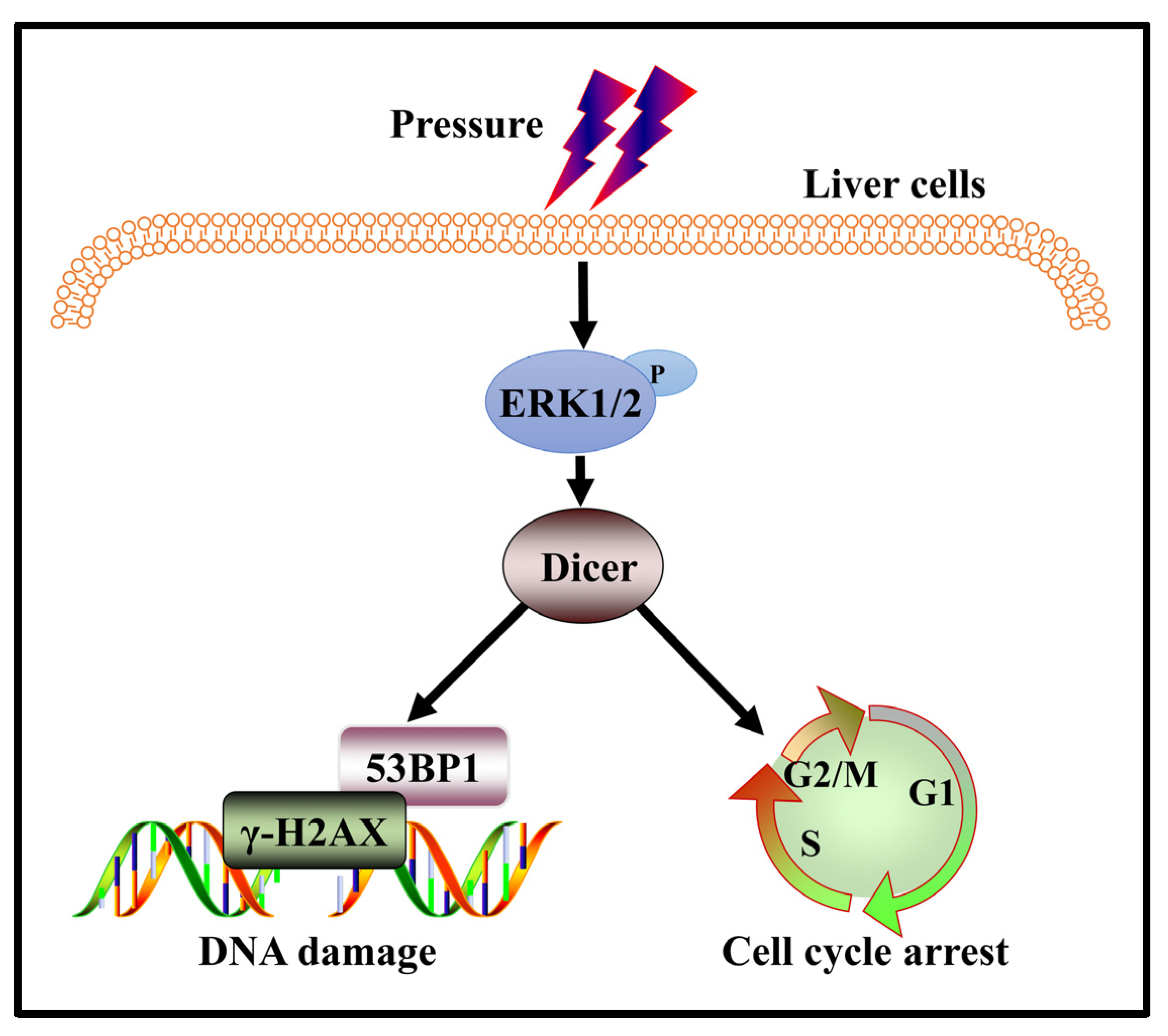
图5 肝细胞中较高压力诱导的DNA损伤的示意图。较高的压应力导致肝细胞的DNA损伤加剧,可激活 ERK1/2 并上调 Dicer 的表达水平。然后,Dicer介导细胞的DDR。在Dicer表达下调后,细胞的DDR功能减弱,细胞的DNA损伤因应激而增强。
总之,研究提供了 ERK1/2-Dicer 信号通路与应激下肝细胞中 DNA 损伤积累之间的重要联系(图5)。研究表明,Dicer 表达的下调导致受到压力的细胞中 DNA 损伤增加和/或 DNA 修复能力降低。压力变化导致细胞周期停滞和 DSB 积累,这是导致基因组不稳定的因素。因此,Dicer 可能成为干预肝硬化期间肝细胞 DNA 损伤的潜在靶点。然而,关于 Dicer 在应对应激诱导的肝细胞 DNA 损伤中的作用的详细机制仍有待研究。
参考文献:Tang Y, Fan Y, Luo Q, Song G. Pressure Loading Induces DNA Damage in Human Hepatocyte Line L02 Cells via the ERK1/2-Dicer Signaling Pathway. Int J Mol Sci. 2022 May 10;23(10):5342. doi: 10.3390/ijms23105342. PMID: 35628153; PMCID: PMC9140865.
原文链接:http://group9-s.ccame.net/35628153/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用!