剪切力激活NOTCH1可立即诱导人软骨细胞中细胞因子的表达
骨关节炎(OA)是最常见的年龄相关性关节疾病,可引起关节疼痛和肿胀。多种因素(包括过度机械负荷和系统性代谢异常)有助于临床OA的发生,但不同关节之间每种因素的权重可能不同。
在细胞水平上,骨关节炎是软骨结构和功能的逐渐丧失。在正常情况下,软骨细胞分泌II型胶原蛋白和蛋白聚糖以维持软骨基质。然而,在OA的进展过程中,软骨细胞通过去分化过程发生表型变化。
OA的分子标志是滑膜微环境中炎性细胞因子升高。这些炎性细胞因子包括IL-6和IL-8。在OA患者的滑液和血清中观察到这两种细胞因子水平升高。此外,IL-1β和TNFα与OA进展有关。IL-1β和TNFα的表达被NFκB和AP-1转录因子激活,从而诱导其他细胞因子和介质(包括MMP9、MMP13和IL-6)的自分泌产生,进一步刺激炎症。
NOTCH1信号对于发育和维持干细胞至关重要。在骨骼和软骨发育过程中,NOTCH1通过激活SOX9的表达来促进软骨细胞的分化。证据还显示,NOTCH1经常在OA软骨的软骨细胞中被激活。因此,NOTCH1信号的激活可能在OA的发病机制中起重要作用。除了调节基质形成外,NOTCH1还能够维持NFκB的激活,并与滑膜细胞和软骨细胞炎性细胞因子表达的增加有关,从而促进OA的进展。尽管 NOTCH1 可能参与 OA 进展,但 NOTCH1 在软骨细胞中的确切功能仍有待说明。
据报道,NOTCH1是内皮细胞中的机械力传感器。台湾省国立中正大学生物医学系、国立嘉义大学生化科学与技术系的一项研究曾报道了流体剪切力诱导NOTCH1下游基因以及炎性细胞因子和趋化因子的立即上调。数据表明,NOTCH1信号作为一个传感器来传递机械压力,并诱导软骨细胞中炎症细胞因子的表达。

软骨细胞剪切应力即时反应基因的鉴定
为了研究机械负荷对软骨细胞功能的影响,实验以低(2 dynes/cm2)或高(15 dynes/cm2)水平的平行方向流体剪切力培养了人软骨细胞系SW1353。通过RNA测序确定流体剪切力处理前后的基因表达谱。
在上调基因中,80个蛋白质编码基因在剪切应力下表现出超过四倍的增加。在这些高活化的基因中,61个基因在低剪切应力和高剪切应力下上调(图1 B),而仅在高剪切应力下的SW1353细胞中,有19个基因上调超过四倍。GO富集分析表明,这些上调基因的分子功能是细胞因子信号传导和转录调控。这些数据表明,软骨细胞对流体剪切力应力的主要细胞反应是炎症反应的激活。
对数据集的检查显示,参与炎症过程的许多基因包括几种炎症细胞因子和趋化因子(图1 C)。在静态条件下,IL-8和CCL3的表达水平极低,但在剪切应力下2 h,两个基因的表达水平均增加了近百倍。除IL-8和CCL3外,TNFα和CSF2在未经处理的细胞中完全检测不到,并且在施加剪切应力后显著增加。与TNFα表达的增加相关,TNFAIP3和TRAF1的水平也急剧增加(图1 C)。TRAF1和TNFAIP3先前都被确定为骨关节炎相关标志物。再加上TNFα表达的增加,这些数据表明,剪切应力激活了TNF信号传导。TNFAIP3具有抑制NFκB激活和TNFα介导的细胞凋亡的功能。此外,NFκB抑制剂NFKB1A和NFKB1Z的表达也增加(图1 C)。

图1 鉴定SW1353中的流体剪切力应力立即响应基因
(A)SW1353细胞经受低(2 dynes/cm2) 或高(15 dynes/cm2)平行流体剪切力30分钟。(B)79和81个基因在低剪切应力和高剪切应力下分别上调了四倍以上。在这两个数据集中,发现61个基因上调。在低剪切应力和高剪切应力下,下调超过4倍的基因数量分别为4个和1个。(C)显示所选剪切应力激活基因的表达水平。
NOTCH1诱导炎症细胞因子
除了免疫调节中的基因功能外,还发现JAG1和HES1表达增加(图1 C)。鉴于JAG1是NOTCH1受体的配体,HES1是激活的NOTCH1信号通路的下游靶标,实验数据表明,NOTCH1信号是由流体剪切力激活的。
以往研究表明,NOTCH1的激活与炎症细胞因子的产生有关。然而,尚不清楚NOTCH1的激活是否直接诱导软骨细胞中炎症细胞因子的表达。为了探索这种可能性,创建了一个EGFP-NOTCH1 PEST结构域删除的细胞内结构域(N1C∆PEST)构建体,并在SW1353中瞬时表达EGFP-N1C∆PEST以模拟NOTCH1的激活。通过RNA测序分析SW1353表达谱的变化。测序结果显示,模拟NOTCH1激活4 h后,在SW1353中,139个基因增加4倍,6个基因表达减少(图2 A)。对这些上调基因的分析表明,NOTCH1信号诱导细胞因子、干扰素、干扰素反应基因、趋化因子和免疫应答调节因子的表达。
将NOTCH1激活基因与流体剪切力应力数据集交叉引用表明,许多流体剪切力应力激活基因也对NOTCH1信号有反应。这些基因包括细胞因子IL-8和TNF以及NFκB信号调控因子NFKB1A、NFKB1Z、TNFAIP3和TRAF1(图2 B)。这一观察结果表明,NOTCH1的激活是流体剪切力应力处理的直接事件,激活的NOTCH1信号反过来诱导细胞因子和免疫调节因子的表达。因此,这些数据表明,NOTCH1在机械力加载的软骨中起诱导炎症反应的作用。
此外,观察到III型干扰素急剧增加,包括IFNL1、IFNL2和IFNL3(图2 B)。许多已知干扰素反应基因的表达也随着干扰素产生的增加而增加(图2 B)。除细胞因子外,参与免疫反应调控的基因也上调。在这些NOTCH1激活基因中,最显著的基因是由CD274编码的PD-L1。PD-L1是抗癌免疫治疗的靶标,但其在OA中的作用尚不清楚。

图2 鉴定SW1353中的NOTCH1激活基因
(A)SW1353用pEGFP-C1和pEGFP-N1C∆PEST转染2小时,并在新鲜培养基中再孵育2小时。收获细胞用于通过RNA测序分析基因表达。(B)NOTCH1诱导的基因根据其功能分为干扰素,干扰素反应基因,细胞因子,趋化因子和免疫调节因子。
为了确认RNA测序的结果,进行了独立的转染实验,并通过定量RT-PCR检查了IL-8、TNF、IFNB1和IFNL1的表达水平。qRT-PCR结果与测序数据一致,表明IL-8、IFNB1和IFNL1显著增加(图3 A)。通过ELISA测定了转染细胞培养基中IL-8的水平。结果表明,在激活的NOTCH1表达后8 h,培养物中IL-8蛋白水平急剧升高(图3 B)。因此,这些数据表明,流体剪切力应力诱导的炎症反应至少部分是由NOTCH1信号激活介导的。
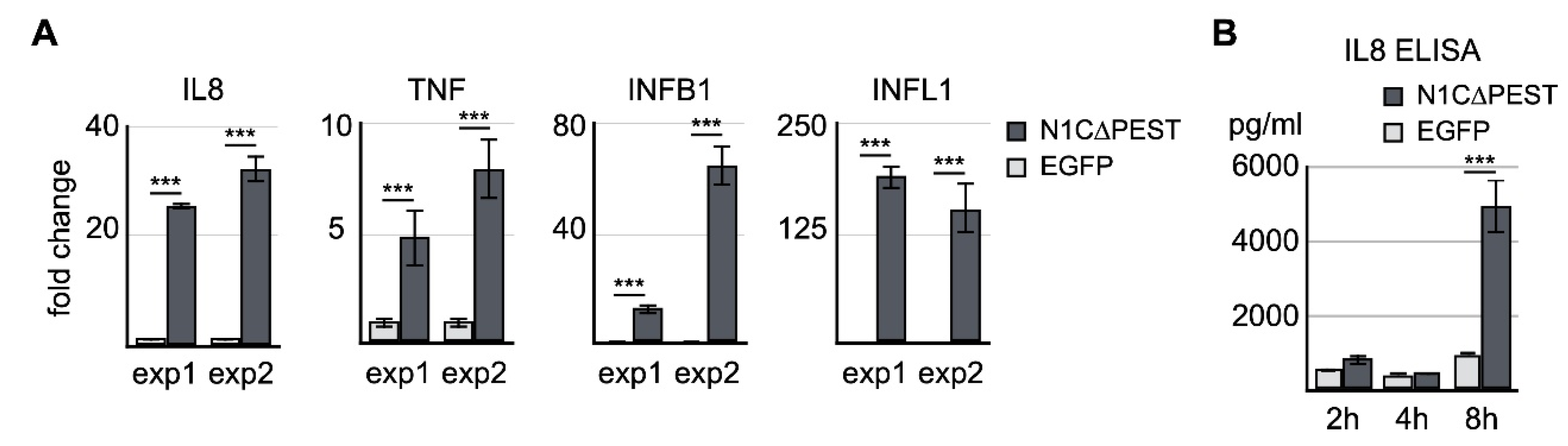
图3 通过qRT-PCR和ELISA确认NOTCH1激活基因
(A)EGFP和EGFP-N1C∆PEST在SW1353中瞬时表达。转染开始4小时后,提取总RNA,并通过qRT-PCR分析IL-8、TNF、IFNB1和IFNL1的表达水平。(B)转染后2小时、4小时和8小时收集培养基。培养基中IL-8的水平由ELISA测定。
NOTCH1诱导的细胞因子对成骨细胞的影响
OA的常见症状是骨刺的生长。一种可能性是来自软骨细胞的NOTCH1诱导的细胞因子随后影响成骨细胞的功能。为了探索这种可能性,实验用EGFP或N1C∆PEST转染SW1353 2小时。
在条件培养基下4小时,在用EGFP条件培养基处理的hFOB 1.19细胞中,9个基因显示出超过四倍的增加,而9个基因显示出超过四倍的减少。相比之下,在N1C∆PEST条件培养基中孵育的hFOB 1.19具有28个上调基因和5个下调基因,变化大于4倍(图4 A)。 对数据的检查表明,这些由N1C∆PEST -条件培养基诱导的基因在炎症和免疫调节中起作用(图4 B)。

图4 通过来自N1C∆PEST转染SW1353的条件培养基上调成骨细胞系hFOB中的细胞因子和趋化因子
(A)在条件培养基下4小时,通过RNA测序分析hFOB的表达谱。(B)条件培养基诱导基因根据其作为趋化因子,细胞因子和免疫调节因子的功能进行分组。
对RNA测序数据的分析表明,在条件培养基下的延长培养过程中,诱导基因的水平开始下降。具体来说,CCL2在24小时后返回到未处理细胞的水平。虽然CXCL2、IFNB1和INFL1的水平没有完全恢复到未经处理的水平,但仍显示出显著下降(图5 A)。另一方面,虽然用EGFP条件培养基处理的hFOB中,CXCL11的表达水平在延长培养后也有所增加,但CXCL11的表达量保持在相似的水平(图5 A)。为确认RNA测序结果,进行了独立实验,通过qRT-PCR证实了CXCL2、CXCL11、IFNB1和IFNL1的表达变化(图5 B)。结果表明,软骨细胞释放的细胞因子对邻近成骨细胞具有短期刺激作用,导致炎性细胞因子在周围环境中进一步积累。

图5 通过N1C∆PEST转染的SW1353条件培养基激活成骨细胞系hFOB中的细胞因子表达
(A)0、4和24小时后,从条件hFOB中收集RNA并通过RNA测序进行分析。(B)另外进行了两项独立实验。采用qRT-PCR测定CCL2、CXCL2、CXCL11和IFNB1的表达水平。
在这项研究中,使用人软骨细胞系SW1353来鉴定流体剪切力应力-即时反应基因。在施加剪切应力时,NOTCH1配体JAG1和下游靶基因HES1迅速而急剧地上调,提供了独立的实验证据,证明NOTCH1在软骨细胞中被机械力激活。NOTCH1已被证明可作为内皮细胞中的机械力传感器。结合实验数据,这些发现表明,NOTCH1在应力承载组织中具有机械力传感器和信号传感器的功能。
参考文献:Cheng HJ, Hsu WT, Chen CN, Li C. Activation of NOTCH1 by Shear Force Elicits Immediate Cytokine Expression in Human Chondrocytes. Int J Mol Sci. 2020 Jul 14;21(14):4958. doi: 10.3390/ijms21144958. PMID: 32674293; PMCID: PMC7404062.
原文链接:https://pubmed.ncbi.nlm.nih.gov/32674293/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用!