SOX4是单细胞分析揭示的动脉粥样硬化内皮细胞的新型表型调节因子
动脉粥样硬化是一种进行性血管疾病,其特征是在动脉内膜积聚的脂质、形成纤维脂质斑块致管壁增厚、管腔狭窄。内皮细胞(ECs)的单层构成血管的内膜,负责生物力学信号的转导和血管张力的调节。ECs功能障碍以内皮依赖性血管扩张和血管收缩不平衡为特征,提示动脉粥样硬化性病变的起始。然而,动脉粥样硬化过程中ECs的详细转录图谱、调控网络和分子特征尚不完全清楚。
慢性血管炎症提供了一个促动脉粥样硬化的微环境,不断刺激ECs,而这种不利条件与西方饮食的增加有关。在这种微环境中,分泌的细胞因子如白细胞介素-1β(IL-1β)和转化生长因子β(TGF-β)的存在促使ECs的表型转变。这种表型改变称为内皮到间充质转化(EndoMT),间充质样ECs逐渐表达VSMC标志物,从而加重动脉硬化。
此外,血管ECs不断暴露于血流产生的机械刺激(即剪切应力),其中不同的剪切模式触发不同的细胞反应。稳定层流剪切应力(LSS)可引起抗炎和抗动脉粥样硬化作用,振荡剪切应力(OSS)则对应于促炎和促动脉粥样硬化作用。然而,很少有研究将成熟和功能性ECs与间充质样ECs的遗传特征进行比较,特别是在动脉粥样硬化性疾病的背景下。
在香港中文大学李嘉诚健康科学研究所、香港中文大学生物医学学院、国家卫生研究院细胞与系统医学研究所的一项研究中,应用scRNA-seq方法(i)探索动脉粥样硬化过程中主动脉ECs的转录景观和异质性;(ii)在功能失调的ECs中鉴定新的和可成药的分子靶点;(iii)将新确定的分子靶点与血管系统的病理状况联系起来;以及(iv)将实验性动脉粥样硬化的发现与人类动脉粥样硬化疾病临床标本中的动脉和ECs相关联。研究结果将为确定针对动脉粥样硬化疾病的替代治疗策略开辟新的机会。以下为部分研究成果分享。

SOX4 在动脉粥样硬化性主动脉中上调
由于转录因子(TFs)代表了真核细胞中各种信号通路的汇合点,因此直接调节TFs功能可能为不同疾病(包括动脉粥样硬化)提供新的治疗见解。在动脉粥样硬化主动脉中,仅在EC和VSMC簇中检测到TF Sox4的上调(图1 A)。尽管在动脉粥样硬化主动脉的EC中也注意到Tcf4上调(图1 A),但其在多个细胞簇中的复杂表达变化表明,Tcf4可能参与多个细胞过程,但不仅仅参与动脉粥样硬化期间的EC功能。为了解开这些TFs下游的效应基因,进行了相互作用组分析。此外,SOX4是某些间充质标志物(即VIM和FN1)的直接上游调节因子,如基因调控网络分析所示(图1 B)。在WD喂养的ApoE−/− 小鼠主动脉根部和人动脉粥样硬化冠状动脉和肾动脉中,分别在斑块区和EC层观察到SOX4上调(图1 C、E)。这种上调伴随着小鼠主动脉和人动脉粥样硬化肾动脉分离的ECs中内皮标志物(即eNOS和PECAM-1)的丢失和间充质标志物(即VIM)的增加(图1 D、F)。
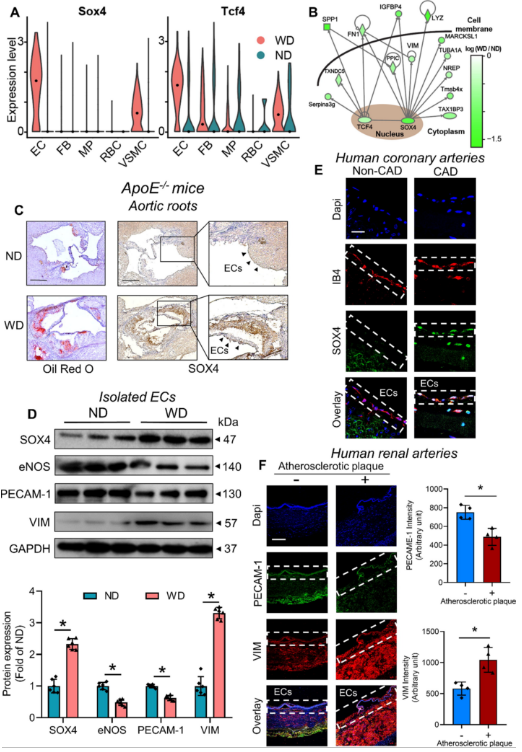
图1 人和小鼠动脉粥样硬化主动脉中的内皮SOX4上调。
(A)不同主动脉细胞中转录因子Sox4和Tcf4表达的图。(B)SOX4与其他蛋白质相互作用组的基因调控网络分析。(C)动脉粥样硬化病变上的油红O染色和ApoE-/- 小鼠主动脉根部SOX4表达的免疫组织化学染色。(D)来自ApoE−/− 小鼠分离的ECs的SOX4,内皮标志物(即eNOS和PECAM-1)和间充质标志物(即VIM)的蛋白质印迹表达水平。(E)人患病冠状动脉和对照胸内动脉内皮细胞中SOX4的免疫荧光染色水平。(F)人肾动脉内皮(PECAM-1)和间充质(VIM)标志物水平的免疫荧光染色。ND:正常饮食;WD:西方饮食。
SOX4过表达的促动脉粥样硬化和促EndoMT 效应
为了了解SOX4在动脉粥样硬化中的作用,在WD喂养前,将内皮特异性AAV-SOX4注射到ApoE−/− 小鼠。结果表明,SOX4过表达增加了ApoE−/− 小鼠主动脉中SOX4蛋白的表达(图2 A)。SOX4过表达增加了ApoE−/− 小鼠面主动脉和主动脉根部的病变区域(图2 B、C)。此外,SOX4过表达导致分离的ECs和主动脉根部的内皮标志物(即eNOS和PECAM-1)丢失和间充质标志物(即VIM)的增加(图2 A、D)。而且,体外腺病毒介导的SOX4过表达在人脐静脉内皮细胞(HUVECs)和人主动脉内皮细胞(HAECs)中引起类似的结果(图2 E-G)。与调控网络一致(图1 B),SOX4过表达增强了ECs中的VIM水平。
此外,实验还研究了SOX4过表达对ECs形态和功能的影响。这种过表达触发了HUVECs和HAECs的伸长(图2 H),以及小鼠主动脉内皮依赖性松弛的损害(图2 I),表示结构改变和内皮功能障碍。这些证据暗示了SOX4的促动脉粥样硬化作用,这与SOX4介导的EndoMT有关。
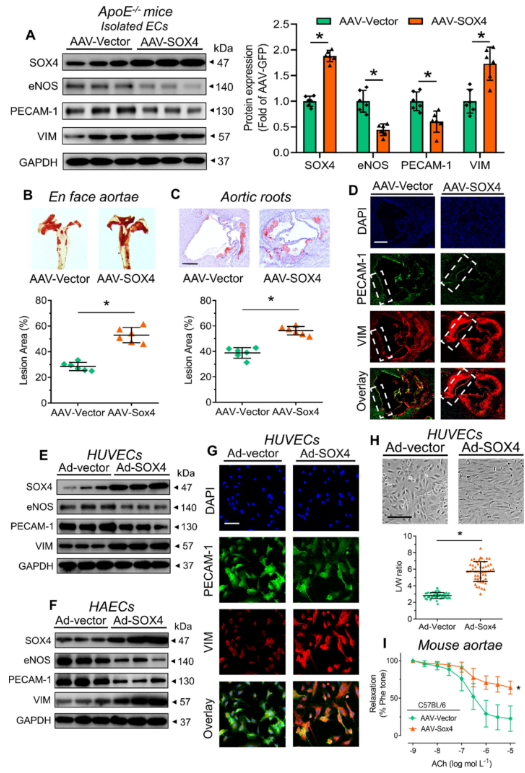
图2 SOX4在内皮细胞中的过表达。
(A)ApoE−/− 小鼠分离的ECs的蛋白质印迹,先前接受尾静脉注射内皮特异性AAV-SOX4。(B、C)注射AAV-SOX4的ApoE−/− 小鼠的(B)面主动脉和(C)主动脉根部动脉粥样硬化病变的油红色O染色。(D)小鼠主动脉根部内皮和间充质标志物的免疫荧光染色。(E、F)在 Ad-SOX4 处理的(E)HUVECs 和(F)HAECs 上进行蛋白质印迹。(G)对Ad-SOX4感染的HUVECs的内皮和间充质标志物进行免疫荧光染色。(H)经Ad-SOX4处理的HUVECs的形态。(I)通过线肌图对Ad-SOX4感染的C57BL / 6小鼠主动脉进行内皮依赖性松弛的功能测定。
二甲双胍抑制细胞因子介导的SOX4上调
接下来,实验旨在揭示SOX4的潜在诱导因子和抑制因子。值得注意的是,西方饮食模式通常与更高水平的循环细胞因子(例如IL-1β)相关,IL-1β和TGF-β1都是动脉粥样硬化期间EndoMT诱导的细胞因子。此外,SOX4先前已被证明是免疫细胞(例如T细胞)中这两种细胞因子的下游靶点。因此,实验想知道IL-1β和TGF-β1是否作为内皮细胞中SOX4介导的EndoMT的上游启动因子。事实上,用IL-1β(10 ng ml−1)进行体外孵育可诱导人肾动脉和 ApoE−/− 小鼠主动脉中的 SOX4 上调和 EndoMT(图3 A-C)。然后进一步验证了暴露于IL-1β和TGF-β1(另一种EndoMT诱导细胞因子)的HUVECs的结果。两种细胞因子的共同处理显著增加了HUVECs中的SOX4蛋白表达和EndoMT(图3 D)。更重要的是,用抗糖尿病药物二甲双胍处理,先前报道是癌中的 SOX4抑制剂,逆转了细胞因子诱导的HUVECs中SOX4表达和EndoMT的升高(图3 D)。更重要的是,siRNA介导的SOX4敲低也逆转了HUVECs中细胞因子诱导的EndoMT(图3 E)。
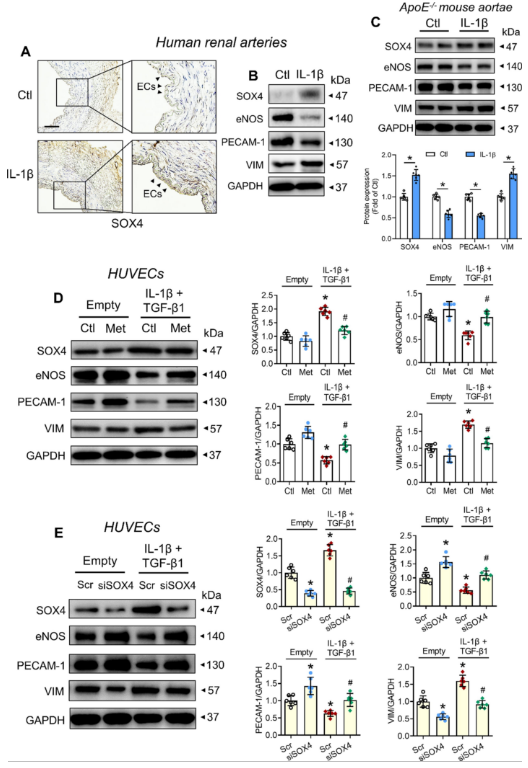
图3 SOX4上调的生化诱导因子。
(A)IL-1β处理的人肾动脉SOX4表达的免疫组织化学染色。(B)IL-1β处理的人肾动脉上的蛋白质印迹。(C)IL-1β 处理的 ApoE−/− 小鼠主动脉的蛋白质印迹。(D)二甲双胍在IL-1β和TGF-β1共同处理的HUVECs中的影响。(E)siRNA介导的SOX4敲低在IL-1β和TGF-β1共同处理的HUVECs中的影响。
OSS 诱导的 SOX4 上调
动脉粥样硬化斑块和动脉瘤往往发生在暴露于血流紊乱的血管区域。由于OSS经历区域(例如小鼠主动脉根部)中的SOX4表达很高(图1 C),实验假设除了细胞因子介导的生化刺激外,SOX4可能对血流诱导的机械刺激敏感。由于相对直的TA和弯曲的AA分别对应于LSS(12 dyn cm2)和OSS(0.5 ± 6 dyn cm2,1 Hz)(图4 A),实验检查了这些血管区域的SOX4水平。位于AA内曲率的ECs中的SOX4表达增加(图4 B),同时AA的整体SOX4表达也较高(图4 C)。然后进一步验证了在体外受血流动力学力作用的HUVECs的结果(图4 D)。暴露于OSS(0.5 ± 6 dyn cm2,1 Hz)24小时后,HUVECs的SOX4水平在转录和翻译上均升高(图4 E),与体内结果一致。
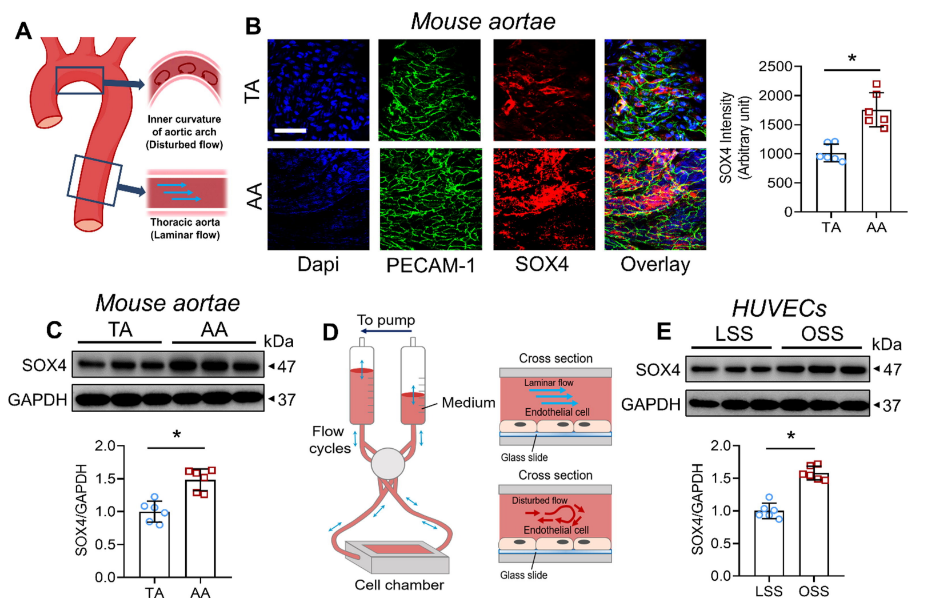
图4 SOX4上调的生物力学诱导因子。
(A)沿主动脉的不同流动模式示意图。(B)小鼠胸主动脉(TA)和主动脉弓(AA)的面部SOX4表达的免疫荧光染色。(C)小鼠TA和AA中SOX4水平的蛋白质印迹。(D)流动系统设计示意图和细胞室横截面。(E)暴露于LSS或OSS 24小时的HUVECs中SOX4水平的蛋白质印迹。
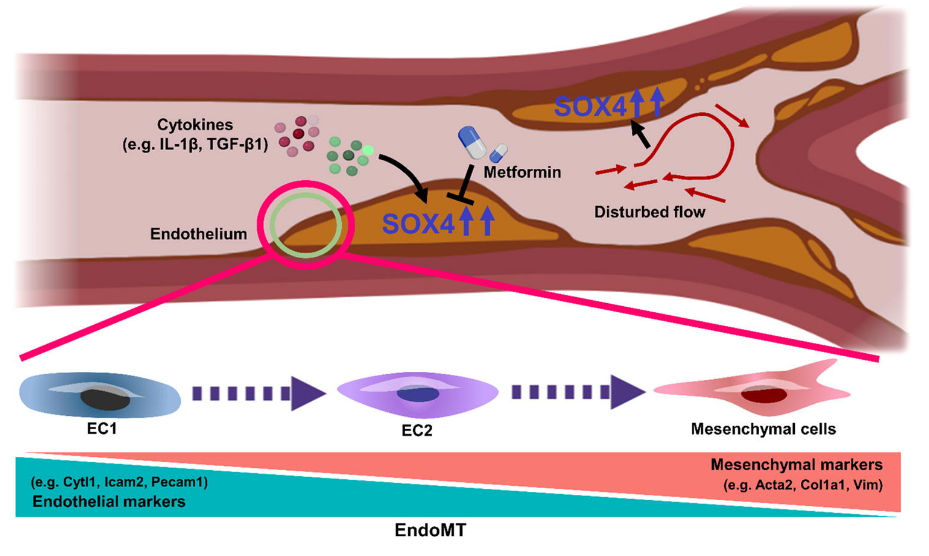
图5 图形概要
高脂血症相关的细胞因子和紊乱的血流上调ECs中SOX4的表达,其中SOX4促进EndoMT和动脉粥样硬化发生。 二甲双胍在药理学上抑制ECs中的SOX4水平。
综上所述,该研究揭示了小鼠动脉粥样硬化主动脉的细胞组成和转录谱,并根据转录和细胞异质性将ECs分为两个亚群。此外,SOX4被成功鉴定为人类和小鼠动脉粥样硬化的新标志物。高脂血症相关细胞因子和流体剪切应力被确定为介导SOX4上调的上游刺激,从而为SOX4加速动脉粥样硬化进展提供了机制见解。二甲双胍被证明可以抑制细胞因子诱导的SOX4上调,为动脉粥样硬化疾病开辟了新的治疗机会。
参考文献:Cheng CK, Lin X, Pu Y, Tse JKY, Wang Y, Zhang CL, Cao X, Lau CW, Huang J, He L, Luo JY, Shih YT, Wan S, Ng CF, Wang L, Ma RCW, Chiu JJ, Chan TF, Yu Tian X, Huang Y. SOX4 is a novel phenotypic regulator of endothelial cells in atherosclerosis revealed by single-cell analysis. J Adv Res. 2023 Jan;43:187-203. doi: 10.1016/j.jare.2022.02.017. Epub 2022 Mar 1. PMID: 36585108.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36585108/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用