牙髓来源的干细胞通过分泌骨保护素和使髓系细胞中的AKT信号失活来抑制破骨细胞分化
破骨细胞(OCs)是多核巨细胞,在病理刺激的影响下(如核因子κβ配体的受体激活剂RANKL),由单核细胞/巨噬细胞谱系分化而来,有助于骨吸收和重塑。成骨细胞(OB)、OCs、骨细胞和其他骨髓细胞之间精确而有序的分子通讯是调节骨形成和吸收所必需的。破骨细胞介导的骨吸收的主要开关是RANKL,一种由活化OBs释放的细胞因子。然而,在各种病理条件下,如关节炎、骨质疏松症和佩吉特骨病,OC介导的骨过度吸收是很明显的。
骨质破坏的本质是通过与滑膜成纤维细胞和免疫细胞相互作用专门激活了OCs。差异激活的巨噬细胞在各种类型的细胞骨架和其他炎症相关疾病的病理生理学中起关键作用,一般来说,M1和M2骨髓细胞分别参与引发和消退炎症。因此,调节巨噬细胞极性的细胞治疗策略可能通过影响骨质疏松症和类风湿性关节炎等疾病中不受控制的破骨细胞分化来提供显著优势。
骨保护素(OPG)是TNF受体超家族的分泌性糖蛋白,对成骨细胞分化至关重要,由于其在抑制破骨细胞分化中的作用,也被称为破骨细胞生成抑制因子(OCIF)。OBs通过产生OPG来负调节OC的分化和功能。研究表明,OPG抑制OC分化,并通过隔离RANKL充当诱饵受体,可阻断 RANK 信号并抑制骨吸收。
牙髓来源的干细胞(DPSCs)是自牙髓中分离的一种间充质干细胞,具有自我更新、多向分化能力,并具有促进血管生成和骨组织修复潜力。此外,DPSCs还被证明具有免疫抑制作用,提示人类DPSCs可用于炎症和自身免疫性疾病,DPSCs分泌多种生长因子和细胞因子,这些因子对各种细胞具有旁分泌活性,以实现其功能和分化。
基于此,美国德克萨斯理工大学健康科学中心的一项研究曾重点阐明了单核细胞/巨噬细胞样细胞系 DPSCs对单核细胞/巨噬细胞样细胞系 RAW 264.7 细胞分化为OCs发挥抑制作用的潜在机制。相关内容发表在 Journal of Cellular and Molecular Medicine 期刊题为“Dental pulp–derived stem cells inhibit osteoclast differentiation by secreting osteoprotegerin and deactivating AKT signalling in myeloid cells”。
首先,为了研究DPSCs对破骨细胞分化的影响,在有或没有DPSCs 状态下在无接触共培养系统中培养破骨细胞前体细胞(RAW 264.7),同时,细胞培养基补充巨噬细胞集落刺激因子(M-CSF)和sRANKL以诱导其向破骨细胞方向分化。TRAP染色显示,在用M-CSF和sRANKL刺激的细胞培养板中观察到多核破骨细胞,而没有M-CSF和sRANKL培养的对照RAW 264.7细胞中没有显示任何多核TRAP阳性细胞。然而,在DPSCs存在时,同一时间点的多核TRAP阳性细胞的丰度明显降低。当DPSC:RAW 264.7细胞比例为1:10时,观察到破骨细胞丰度的剂量依赖性减少,其抑制作用比细胞比例为1:100时更有效。与没有DPSCs的RAW 264.7细胞相比,在无接触共培养条件下,在DPSCs存在下分化的RAW 264.7细胞中TRAP阳性的多核细胞数量明显减少。这些观察表明,DPSCs能够抑制破骨细胞分化。
然后,进一步验证了DPSCs对破骨细胞分化的影响,在存在或不存在无接触DPSCs共培养的情况下,评估了RAW 264.7细胞在诱导分化6天后各种破骨细胞相关标记基因的mRNA表达。定量PCR分析显示,分化后的破骨细胞相关基因,如Nfatc1、组织蛋白酶K(Ctsk)、Rank、Trap和MMP9等关键基因显著上调。这些结果证实了RAW 264.7细胞成功分化为OCs。然而,在DPSCs存在下,破骨细胞相关标记基因(如Nfatc1、Ctsk、Rank、Trap和Mmp9)的mRNA表达以剂量依赖性方式显著降低。
为了确认基因表达向蛋白质的翻译,在分化6天后,对分离的总蛋白质进行了蛋白质印迹分析。与未分化细胞相比,破骨细胞分化细胞中NFATc1、Ctsk、MMP9和p65的蛋白质水平显著升高,然而,当在DPSC以剂量依赖性方式存在诱导分化时,蛋白质水平明显降低。此外,与对照RAW 264.7细胞相比,分化细胞中的NFATc1、Ctsk、MMP9和TRAP阳性多核OCs显著增加(图1 A、B),而在DPSCs存在下观察到分化相关蛋白的数量显著减少(图1 A、B)。

图1 DPSCs抑制RAW 264.7细胞中的破骨细胞分化相关分子。
DPSCs具有免疫调节作用,并可能进一步调节破骨细胞分化过程。因此,接下来测试了DPSCs在RAW 264.7细胞中是否有任何免疫调节作用,在存在或不存在DPSCs的情况下对RAW 264.7细胞进行了无接触共培养。与对照组相比,在DPSCs存在下,炎症基因之一TNF-α的表达显著下调(图2 A),相反,IL-4Rα,一种抗炎基因的mRNA表达上调(图2 A)。此外,作为RAW 264.7细胞M2表型特征的精氨酸酶1(Arg1),Ym1(Chil3)显著增加(图2 B)。这些数据表明,DPSCs可能具有将巨噬细胞极化为抗炎表型的能力,从而负向调节破骨细胞的分化。
为了进一步了解DPSCs调节骨髓细胞分化的机制,在无接触共培养条件下在存在或不存在DPSCs的情况下,还评估了RAW 264.7细胞在诱导分化6天后破骨细胞抑制因子骨保护素(OPG)的基因和蛋白质表达。定量PCR分析显示,诱导破骨细胞分化6 天后,RAW 264.7细胞OPG mRNA显著降低。然而,在DPSCs存在下诱导RAW 264.7细胞分化为OCs时,OPG的mRNA表达以剂量依赖性方式显著增加。然后,使用Transwell共培养系统确定了哪些细胞在OCs分化过程中分泌OPG,发现从对照 RAW 264.7 细胞或分化 OCs 收集的上清液中没有可检测到的 OPG 范围。然而,在整个分化过程中,在DPSCs存在下,培养上清液中的OPG水平显著升高。这些结果表明,RAW 264.7细胞可能没有分泌OPGs。
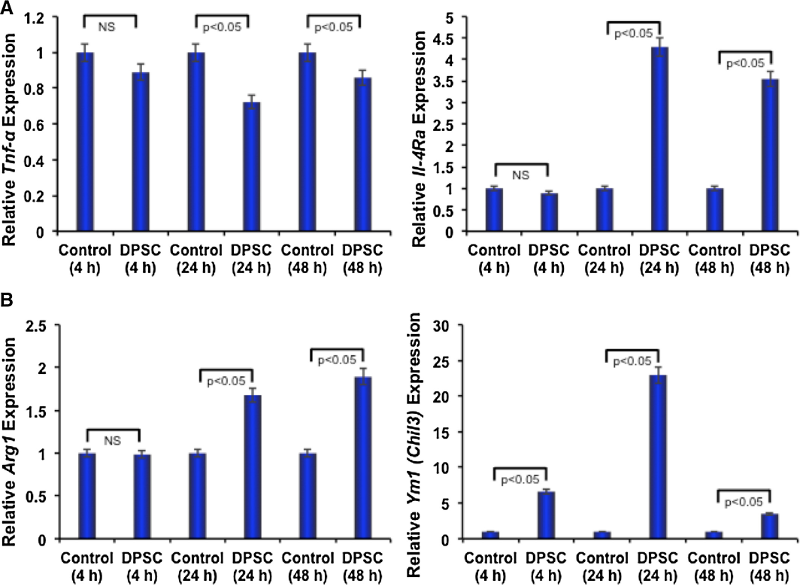
图2 DPSCs抑制促炎基因和诱导M2表型分子抗炎基因的表达。
进一步地,为了确定DPSC是否可以表达和分泌组成型DPSCs,在不同的培养条件下培养DPSCs,在血清饥饿条件下(含1% FBS的DMEM),在培养48和72小时后收集上清液。OPG的mRNA表达显示,与用含10% FBS的培养基培养的DPSCs相比,血清饥饿在两个时间点均显著诱导DPSCs中的OPG表达。然后测量了上清液中分泌的OPG量,发现血清饥饿后OPG水平显著升高。进一步研究的证实了DPSC在含10% FBS和在受损环境下的培养基中均分泌了OPG。这些观察表明,DPSCs可以在胁迫条件下分泌组成型OPG,培养基对OPG分泌没有显著影响。
为了研究OPG对破骨细胞分化相关分子的影响,在存在或不存在不同浓度的重组OPG的情况下诱导了RAW 264.7细胞的破骨细胞分化,并进行了实时RT-PCR和蛋白质印迹分析。分析显示,在破骨细胞分化6天后,在OPG存在下,关键的破骨细胞相关基因(如Nfatc1、Ctsk、Rank、Trap和Mmp9)显著降低(图3 A)。此外,与分化的OCs相比,存在OPG时,关键破骨细胞相关蛋白NFATc1、Ctsk 和MMP9水平降低(图3 B)。这些观察结果支持OPG抑制破骨细胞分化相关标志物分子的能力。
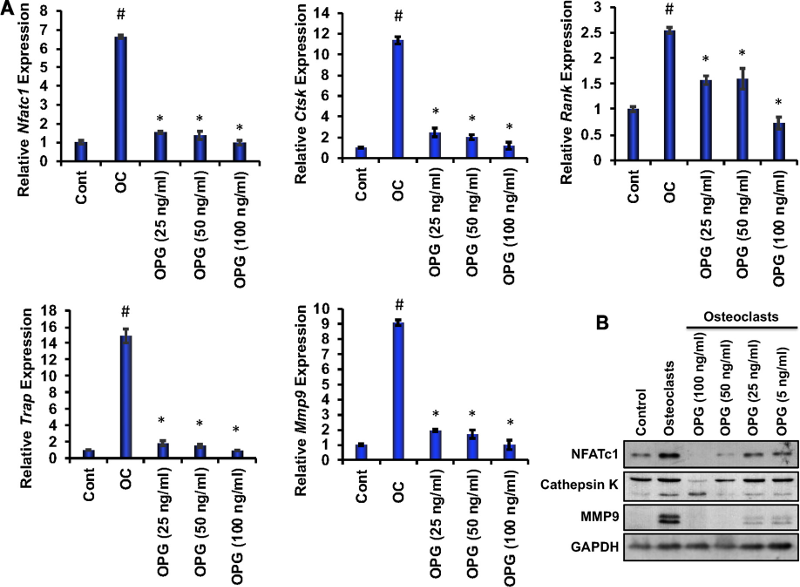
图3 重组OPG以剂量依赖性方式抑制破骨细胞分化相关分子。
最后,为了确定DPSC介导的抑制骨髓细胞破骨细胞分化的分子机制,在存在或不存在各种浓度的重组OPG或PI3K抑制剂或DPSCs的情况下诱导RAW 264.7细胞分化。首先,较高浓度(50 ng/mL和100 ng/mL)的OPG显著抑制了OCs的分化,而较低浓度(5 ng/mL和25 ng/mL)的OPG对抑制破骨细胞分化的作用不大(图4 A、B)。
蛋白质印迹分析显示,活化的AKT(磷酸化AKT)在OCs中上调,而OPG的添加以浓度依赖性方式抑制AKT的活化(图4 C)。在无接触共培养中存在DPSCs的情况下,也观察到AKT活化(磷酸化)的抑制(图4 D)。这些数据表明,DPSC介导的破骨细胞分化抑制模仿了OPG介导的破骨细胞分化抑制的信号级联反应。通过使用PI3K特异性抑制剂进一步证实了PI3K-AKT通路在破骨细胞分化过程中的参与,发现PI3K抑制剂以剂量依赖性方式显著降低了破骨细胞分化(图4 E、F)。
为了确定DPSC是否通过OPG抑制RAW 264.7细胞的破骨细胞分化,实验在Transwell培养系统中在存在或不存在DPSC或DPSC加抗OPG Ab的情况下诱导破骨细胞分化。TRAP染色显示,DPSC的存在降低了破骨细胞分化,并且在培养物中加入抗OPG Ab以及DPSC以剂量依赖性方式显著恢复了破骨细胞分化。这些结果证实了OPG介导的对破骨细胞分化的抑制部分通过DPSC。

图4 DPSC模仿OPG介导的信号通路(PI3K)来抑制破骨细胞分化。
总之,该研究表明,人类DPSCs通过组成性分泌OPG,降低RAW 264.7细胞中关键OC标志物(如NFATc1、Ctsk、TRAP、RANK和MMP-9)的表达来抑制破骨细胞的发生。OPG可能会阻断RANK-RANKL相互作用,这对于OCs的分化至关重要。此外,DPSCs降低了RAW 264.7细胞的炎症信号,并将RAW 264.7细胞极化为M2表型,从而抑制破骨细胞分化。研究进一步证实,在OC分化过程中,OPG介导的PI3K信号通路(AKT)激活的抑制趋势与DPSC介导的OC分化抑制相似。使用抗OPG抗体的挽救实验部分证实了OPG介导的DPSCs抑制OC分化的可能性。这项研究提供了DPSC介导的破骨形成机制抑制的证据。
参考文献:Kanji S, Sarkar R, Pramanik A, Kshirsagar S, Greene CJ, Das H. Dental pulp-derived stem cells inhibit osteoclast differentiation by secreting osteoprotegerin and deactivating AKT signalling in myeloid cells. J Cell Mol Med. 2021 Mar;25(5):2390-2403. doi: 10.1111/jcmm.16071. Epub 2021 Jan 28. PMID: 33511706; PMCID: PMC7933945.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33511706/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。




