骨髓间充质干细胞对骨关节炎的治疗效果通过激活暴露于缺氧引起的 KDM6A / SOX9 信号通路而得到改善
作为一种影响全球数百万人生活的慢性疾病,骨关节炎(OA)主要诱发残疾,关节僵硬和疼痛。OA 的药物治疗主要使用非甾体抗炎药来缓解 OA 引起的疼痛和炎症。然而,许多 OA 患者在疾病的后期阶段需要关节置换疗法。
骨髓来源的 MSCs(BMSCs)是一种来自骨髓的间充质干细胞,具有多能分化潜能,还可以进行自我更新,产生免疫调节反应,已被广泛用于软骨损伤和关节疾病的治疗。此外,BMSCs 已在实验和临床试验中用于治疗 OA。虽然 BMSCs 在治疗 OA 中的详细机制尚不清楚,但怀疑 BMSCs 通过分泌一系列免疫因子和细胞因子来发挥免疫调节和抗炎作用。
缺氧可导致新陈代谢水平升高。在缺氧环境中培养 MSCs 期间,细胞显示出一组独特的分化,增殖和衰老特性。除此之外,MSCs 和 BMSCs 在低浓度氧气条件下的分化行为可以帮助我们了解这些细胞在严重缺氧下的修复潜力。然而,当 MSCs 和 BMSCs 被植入严重缺氧的环境中时,它们有时无法正确区分。
UTX 基因中的纯合性缺失突变,也称为赖氨酸特异性去甲基化酶6A(KDM6A),已在许多原发性肿瘤中发现。SOX9 是一种软骨转录因子,其信号激活水平降低是由 OA 发病机制期间关节软骨的严重损伤引起的。
据报道,缺氧暴露可激活 KDM6A 的表达,KDM6A 随后使 SOX9 启动子去甲基化。SOX9 的下调参与 OA 的发病机制。因此,同济大学附属上海市第四人民医院骨科、同济大学附属上海市肺科医院、上海交通大学附属第一人民医院骨科的研究课题组曾建立了 OA 动物模型,并在正常氧或缺氧下与 BMSCs 共培养的关节软骨细胞(ACCs)进行治疗,以研究 BSMC 预处理对 OA 的治疗效果。

与 BMSCs 共培养可提高 ACCs 的软骨分化
在常氧或缺氧条件下,在单一培养和与 BMSCs 共培养下测量 ACC 颗粒的大小和重量。如图1所示,通过与 BMSCs 共培养,ACC 颗粒的尺寸(图1 a)和重量(图1 b)增加。此外,作为软骨分化的主要参与者,发现在缺氧条件下与 BMSCs 共培养的 ACCs 中 S-GAG(硫酸化糖胺多糖)水平显著升高(图1 c)。此外,通过与 BMSCs 共培养,ACCs 的增殖速率显著提高(图1 d)。
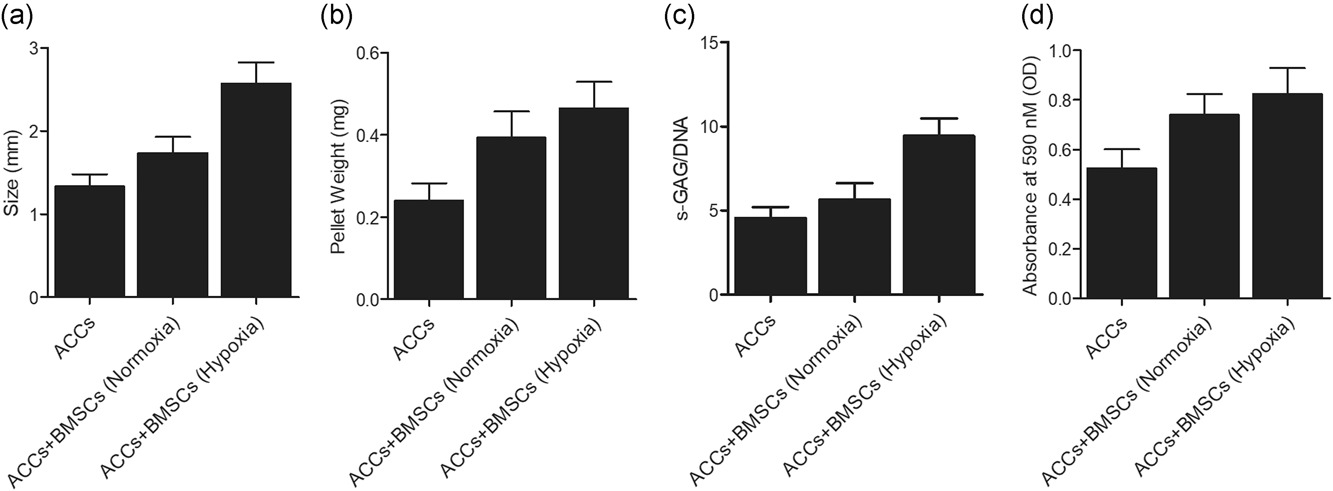
图1 sGAG 检测表明,与 BMSCs 共培养可增强 ACCs 的软骨分化。
与 BMSCs 共培养的 ACCs 中 KDM6A 和 SOX9 的表达增加
定量 RT-PCR 和蛋白质印迹分析 KDM6A 和 SOX9 的表达。缺氧条件下,KDM6A mRNA 在与 BMSCs 共培养的 ACCs 中显著上调(图2 a)。同样,在缺氧下与 BMSCs 共培养,ACCs 中的 SOX9 mRNA 表达也升高(图2 b)。蛋白质印迹分析显示 KDM6A 和 SOX9 的蛋白质表达趋势相似(图2 c)。
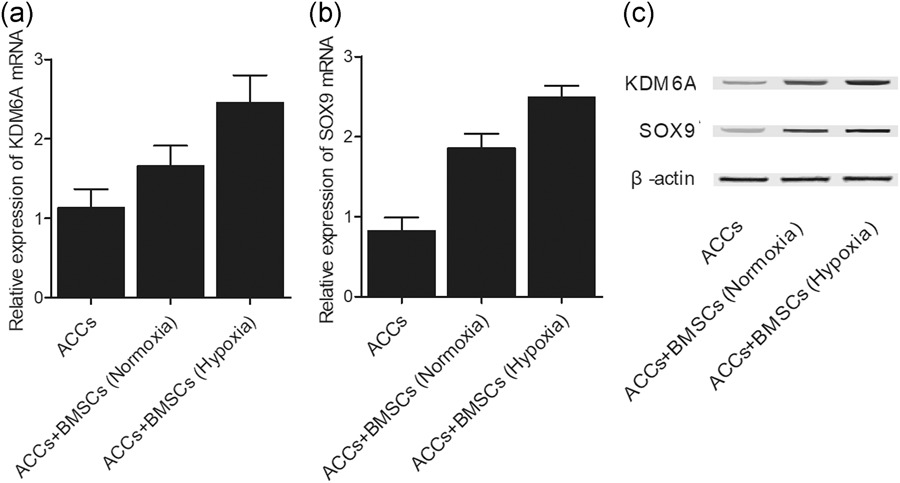
图2 定量实时荧光定量 PCR 和蛋白质印迹表明,在正常氧和缺氧条件下,KDM6A 和 SOX9 在与 BMSCs 共培养的 ACCs 中表达增加。
2型胶原蛋白和 Aggrecan mRNAs 在与 BMSCs 共培养的 ACCs 中的表达升高
此外,在常氧和缺氧下,在单一培养 ACCs 和与 BMSCs 共培养的 ACCs 中评估了 2型胶原蛋白和 Aggrecan(软骨蛋白聚糖)的 mRNA 表达。缺氧条件下,2型胶原蛋白(图3 a)和 Aggrecan(图3 b)的 mRNA 表达在与 BMSCs 共培养的 ACCs 中上调。
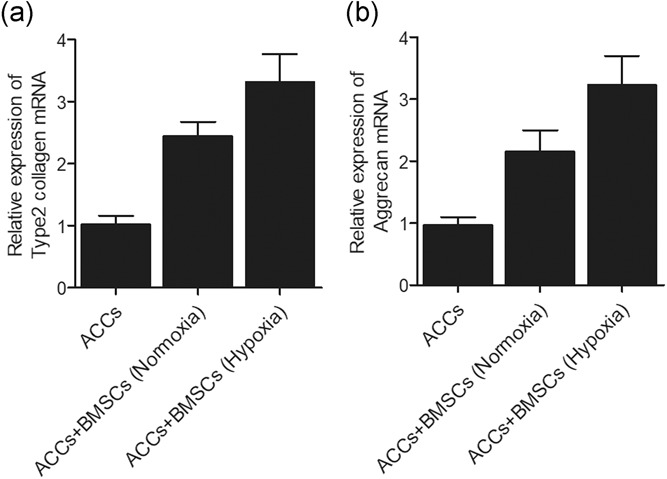
图3 实时荧光定量 PCR 表明,在正常氧和缺氧条件下,与 BMSCs 共培养的 ACCs 中,2型胶原和 Aggrecan 的 mRNA 表达增强。
在与 BMSCs 共培养的 ACCs 中,SOX9 启动子的 DNA 甲基化降低
基因启动子中的 DNA 甲基化可以对基因表达进行负调节。如图4 所示,进行了亚硫酸氢盐测序 PCR,以分析在各种条件下处理的 ACCs 中 SOX9 启动子的 DNA 甲基化状态。缺氧条件下,与 BMSCs 共培养的 ACCs 中,SOX9 启动子的 DNA 甲基化显著降低。

图4 亚硫酸氢盐测序PCR 表明,在正常氧和缺氧状态下,与 BMSCs 共培养的 ACCs 中 SOX9 启动子的 DNA 甲基化降低。
与 BMSCs 共培养抑制了 ACCs 的凋亡
使用流式细胞术评估 ACCs 在不同条件下的凋亡状态。如图5 所示,在缺氧状态下与 BMSCs 共培养显著抑制了 ACCs 的凋亡。这些结果表明,ACCs 和 BMSCs 的共培养显著抑制了 ACCs 的凋亡。

图5 流式细胞术表明,在正常氧和缺氧状态下,与 BMSCs 共培养可降低 ACCs 的凋亡。
ACCs 与 BMSCs 共培养可减轻软骨损伤
建立 OA 大鼠模型,并在正常和缺氧条件下 BMSCs 与 ACCs 共培养。对 OA 大鼠模型软骨病变进行 Mankin 病理评分(骨性关节炎软骨退变程度进行评价的通用标准),发现 OA 大鼠中显示出显著更高的 Mankin 评分。在缺氧下用 ACCs 与 BMSCs 共培养后,OA 大鼠的 Mankin 评分显著降低(图6)。
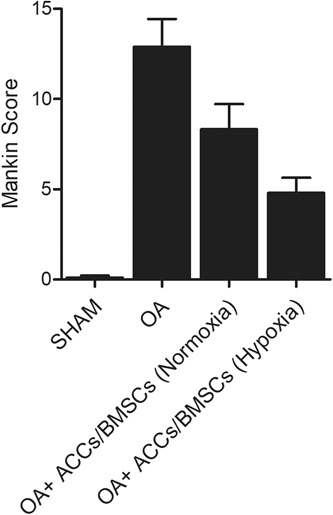
图6 软骨病变的 Mankin 分级表明,在正常氧和缺氧下,BMSCs 与 ACCs 共培养可减弱 OA 大鼠软骨病变。
BMSCs 与 ACCs 共培养增加了 OA 大鼠 KDM6A 和 SOX9 的表达
使用 qPCR 检查 KDM6A 和 SOX9 在 OA 大鼠中的 mRNA 表达。OA 大鼠 KDM6A 和 SOX9 的 mRNA 表达明显被抑制,而在正常氧和缺氧下,ACCs 与 BMSCs 共培养的 OA 大鼠 KDM6A(图7 a)和 SOX9(图7 b)的表达显著增加。此外,在不同条件下评估了 SOX9 启动子的 DNA 甲基化。OA 大鼠 SOX9 启动子的 DNA 甲基化逐渐增加,而在正常氧和缺氧下 ACCs 与 BMSC 共培养的 OA 大鼠中 SOX9 启动子的 DNA 甲基化降低(图7 c)。
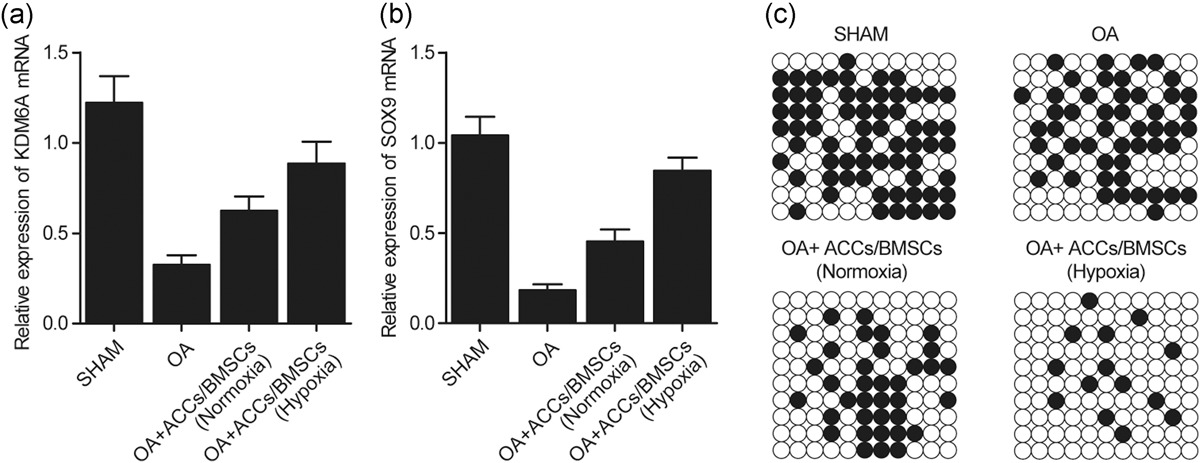
图7 定量实时荧光定量 PCR 和亚硫酸氢盐测序 PCR 表明,与 BMSCs 共培养的 ACCs 处理增加了 OA 大鼠 KDM6A 和 SOX9 mRNA 的表达。
总之,该研究数据表明,缺氧通过促进 KDM6A 表达和激活 SOX9 信号通路来改善 BMSCs 的分化和增殖。这是 BMSCs 分化的一种新机制,为 OA 治疗带来了光明的前景。
参考文献:Zhi Z, Zhang C, Kang J, Wang Y, Liu J, Wu F, Xu G. The therapeutic effect of bone marrow-derived mesenchymal stem cells on osteoarthritis is improved by the activation of the KDM6A/SOX9 signaling pathway caused by exposure to hypoxia. J Cell Physiol. 2020 Oct;235(10):7173-7182. doi: 10.1002/jcp.29615. Epub 2020 Feb 5. PMID: 32020624.
原文链接:http://group9-s.ccame.net/32020624/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞共培养技术及应用!