活化的星状细胞旁分泌HGF加剧胰腺癌细胞铁死亡抵抗力
胰腺导管腺癌(PDAC)以对传统治疗的耐药性而闻名,复发率高,5年生存率低。最近,一些报告显示,PDAC更容易受到铁死亡诱导剂的影响。铁死亡是一种新型的铁依赖性程序性细胞死亡,其特征是膜脂质过氧化产物的积累和质膜多不饱和脂肪酸的消耗,区别于细胞凋亡、细胞坏死、细胞自噬。癌细胞具有高表达的FSP1、SLC7A11 和GPX4 来抵抗铁死亡。作为肿瘤组织中最丰富的基质细胞,癌症相关成纤维细胞(CAFs)在铁死亡过程中的作用仍未被发现。
胰腺星状细胞(PSCs)是胰腺癌CAFs的主要来源,与PDAC的发生和发展密切相关。在小鼠PDAC的原位异种移植模型中,共植入癌细胞和CAFs导致治疗耐药性和氧化还原状态增加。此外,PSCs可以通过直接和间接的方式与癌细胞相互作用,以支持肿瘤非必需氨基酸和脂质生物合成代谢,从而进一步促进癌细胞存活和细胞死亡抵抗。由于氧化还原状态和脂质生物合成在癌细胞铁死亡中的关键作用,因此可推测PSCs可能在旁分泌途径中发挥作用,以促进胰腺癌细胞铁死亡抵抗。
为了验证这一假设,江苏大学附属医院影像科、医学检验科以及江苏大学医学院的研究团队使用共培养模型,并揭示了活化的 PSCs 促进胰腺癌细胞铁死亡抵抗的机制。活化的 PSCs 分泌 HGF,导致胰腺癌细胞中肝细胞生长因子受体(c-MET)表达增加并增强抗氧化能力。因此,有可能将抗纤维化药物与铁死亡诱导剂联合使用,作为一种新的潜在临床治疗策略,以促进难治性的胰腺癌铁死亡。

活化的 PSCs 促进胰腺癌细胞铁死亡抵抗作用
为了研究 PSCs 在胰腺癌细胞铁死亡敏感性中的作用,将分离的原代 PSCs 与 Panc02 细胞共培养(图1)。与对照PSCs相比,共培养的PSCs(Co-PSCs)显示出多边形和扁平的形态,并且代表脂滴的红色细胞群数量减少。研究表明,α-SMA表达上升被认为是PSCs活化的显著特征。蛋白质印迹、qRT-PCR 和免疫荧光显示,α-SMA 在 Co-PSCs 中的表达水平显著上调。这些结果表明,分离的原代 PSCs在胰腺癌细胞存在下被激活。
接下来,评估了有或没有活化的PSCs的胰腺癌细胞的铁死亡敏感性。Panc02与或不与活化的PSCs共培养,然后用Erastin(铁死亡诱导剂)或 RSL3(GPX4 的抑制剂)处理。与对照组相比,Erastin和RSL3可显著诱导细胞死亡,可通过铁死亡挽救剂 Fer-1 挽救细胞死亡,提示Panc02细胞发生了铁死亡。此外,在活化的 PSCs 存在下,Erastin 或 RSL3 诱导的细胞死亡被逆转。
在活化的PSCs存在下,Panc02中GPX4的mRNA和蛋白质水平表达显著增加,SLC7A11仅在mRNA水平升高,而FTH1和NCOA4(铁代谢指标)的mRNA水平没有显著改变。此外,还评估了铁2+ 水平,结果显示Erastin和RSL3升高了Panc02细胞铁2+ 水平。相比之下,活化的 PSCs 对铁2+ 没有显著影响。SLC7A11作为Xc-系统的主要亚基,能够将胱氨酸转运进胞内,合成GSH,稳定GPX4的表达与活性,抑制细胞脂质过氧化。因此实验研究了活化的PSCs是否影响Panc02细胞中的GSH浓度。在Erastin和RSL3处理后,Panc02细胞中的GSH水平受到抑制,MDA水平(脂质过氧化的终产物)升高,通过与活化的PSCs共培养来抵消。同时,与活化的PSCs共培养可有效抑制铁死亡诱导剂诱导的脂质ROS积累。以上的结果都表明,活化的PSCs介导了胰腺癌细胞的铁死亡抵抗。
图1 建立Panc02细胞共培养系统的模型。
活化的 PSCs 分泌的 HGF 介导胰腺癌细胞中的铁死亡抵抗
活化的 PSCs 根据分泌的各种细胞因子调节胰腺癌细胞生物学。接下来,实验评估了这些细胞因子在Co-PSCs中mRNA水平的表达。CCL7、HGF、CCL2、SDF-1α、IGF-1 和 CCL5 在 Co-PSCs 中上调,其中 HGF 上调最显著。ELISA 测定进一步证实,共培养的 PSCs 分泌的 HGF 显著增加。
为了进一步验证活化的PSC衍生的HGF在Panc02铁死亡中的作用,用HGF(5 ng/ml)培养Panc02细胞,然后用不同浓度的铁死亡诱导剂处理。与正常对照组相比,用HGF处理的Panc02癌细胞在铁死亡诱导剂存在下增强了细胞活力(图2 c)。然后,用以下条件处理Panc02:(1)DMSO,(2)HGF(5 ng/ml),(3)Erastin(2 μM)或RSL3(0.1 μM)和(4)HGF(5 ng/ml)+ Erastin (2 μM)/ RSL3(0.1 μM)。与DMSO组相比,HGF处理增加了SLC7A11和GPX4 的mRNA的表达水平以及GPX4的蛋白质水平表达(图2 d、e)。HGF逆转了由Erastin或RSL3诱导的GSH降低和MDA积累(图2 f、g)。此外,与Erastin/RSL组相比,HGF+Erastin/RSL3组在Panc02细胞中抑制脂质ROS水平(图2 h)。这些数据表明,活化的PSCs分泌的HGF促进了胰腺癌细胞的铁死亡抵抗。
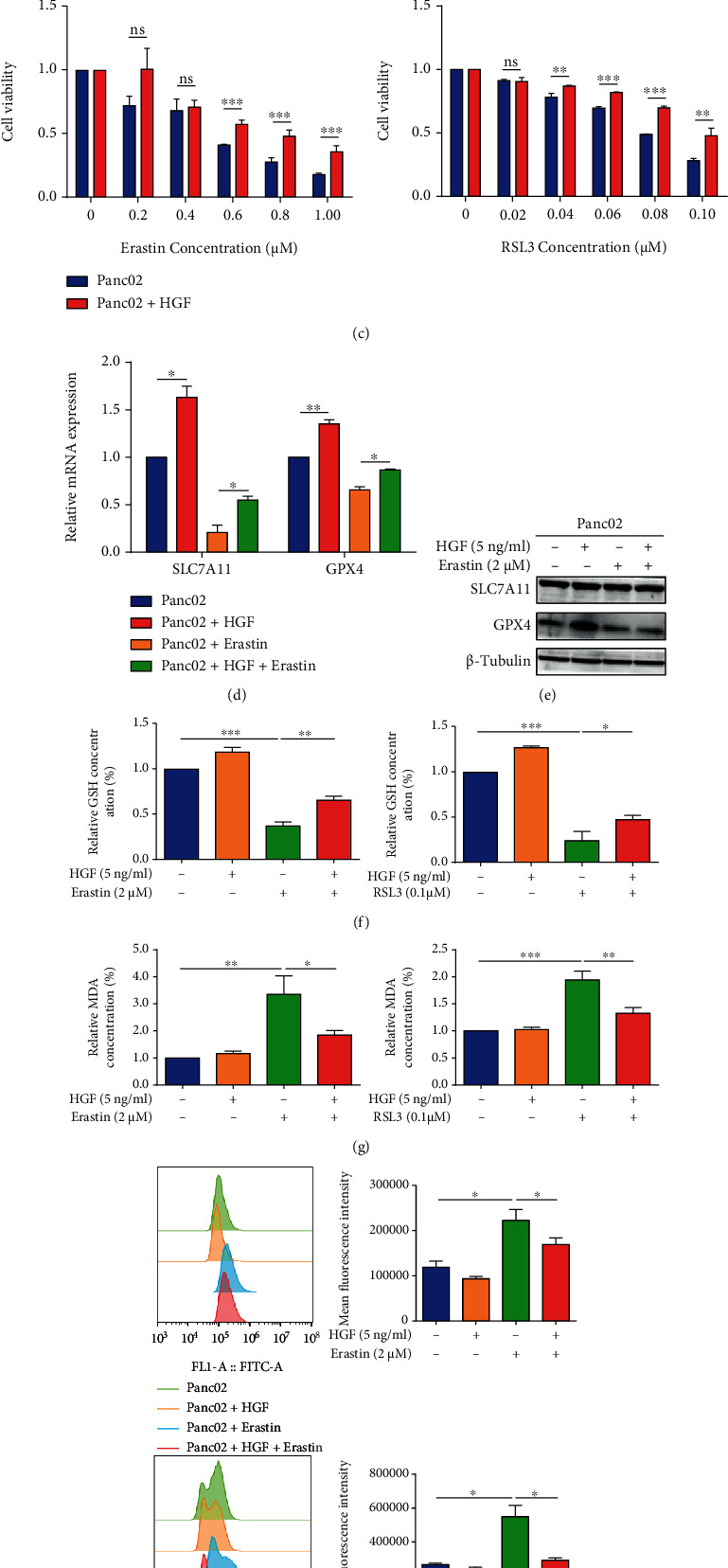
图2 活化的 PSCs 分泌的 HGF 介导胰腺癌细胞中的铁死亡抵抗。
在存在活化的 PSCs 的情况下抑制 c-MET 致敏胰腺癌细胞对铁死亡的抑制
c-间充质-上皮转化(c-MET)是一种HGF受体,已被证明在各种癌症的治疗耐药性中起着决定性的作用。为了进一步确认HGF/c-MET轴在Panc02铁死亡抗性中的作用,实验在共培养系统中添加了c-MET抑制剂c-MET-IN-1。c-MET-IN-1显著增强了胰腺癌细胞对铁死亡的敏感性,降低了细胞存活率。c-MET-IN-1联合铁死亡诱导剂(Erastin和RSL3)降低了GPX4 蛋白表达水平。c-MET-IN-1还显著促进了铁死亡诱导剂诱导的GSH降低以及MDA和脂质ROS的积累。
除了在药理学水平上抑制c-MET外,实验还选择两种稳定的c-MET敲低胰腺癌细胞克隆(c-MET shRNA2和shRNA3),且具有更高的沉默效率(图3 g)。Erastin 和 RSL3 在共培养条件下或在存在 HGF下诱导更多c-MET敲低的胰腺癌细胞死亡(图3 h)。敲低c-MET在Panc02细胞的mRNA和蛋白质水平上下调了GPX7,而不是SLC7A11(图3 i-j)。此外,在铁死亡诱导剂存在下,c-MET的敲低降低了活化的PSCs共培养和HGF处理的胰腺癌细胞中的GSH含量并增加了脂质过氧化终产物MDA的生成和脂质ROS的产生(图3 k)。
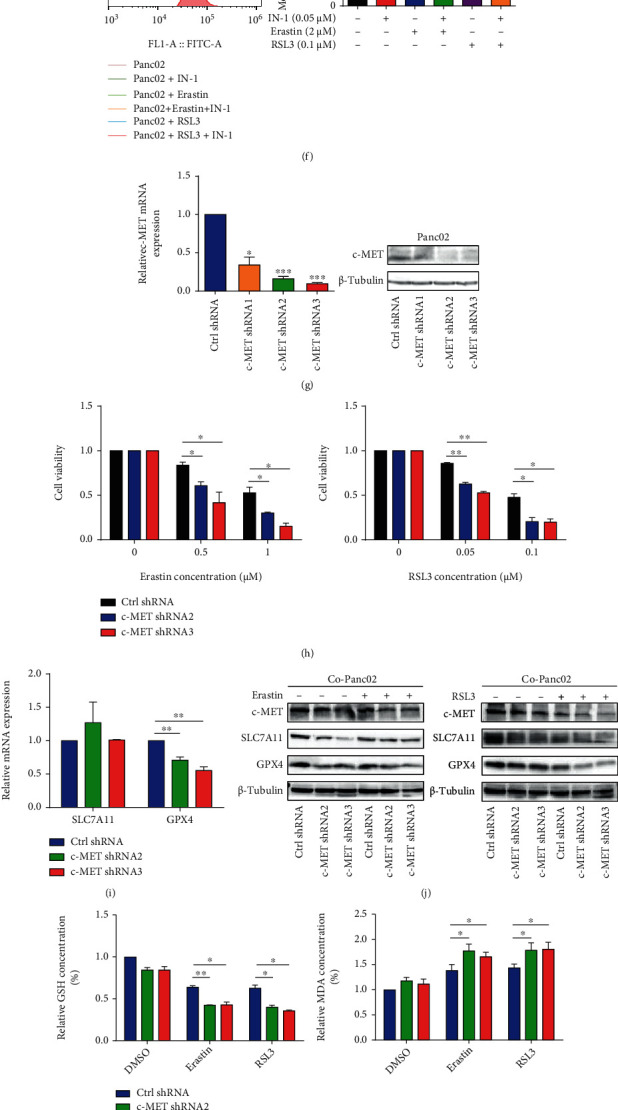
图3 抑制c-MET使胰腺癌细胞在活化的PSCs存在下对铁死亡敏感。
活化的 PSCs 促进体内胰腺癌的铁死亡抵抗力
为了进一步证实体外观察结果,实验接下来研究了活化的PSCs和HGF是否在促进体内胰腺癌的铁死亡抵抗中起作用。然后在C57BL/6小鼠皮下注射有或没有活化的PSCs的Panc02。将C57BL/6小鼠随机分为以下几组:(1)DMSO(对照组),(2)PSCs,(3)HGF,(4)PE,(5)PSCs+PE和(6)HGF+PE,并每两天用相应的药物治疗一次。哌嗪埃拉斯汀(PE)有效抑制C57BL/6小鼠皮下肿瘤的生长。与对照组相比,PE组体重较低,GSH水平降低,MDA水平升高。与对照组相比,PSC+PE和HGF+PE组的肿瘤体积以及GSH和MDA水平均无显著变化。与PE组相比,PSC+PE和HGF+PE组表现出GSH水平升高和MDA水平降低。同时,PSC组和HGF组也显示出相对于对照组更高的GPX4表达水平。与体外结果一致,PSCs与HGF在体内也参与了胰腺癌的铁死亡抵抗。
免疫组织化学还进一步证明了c-MET在PSC和HGF组肿瘤组织中的高表达。GEPIA数据库显示,c-MET在人类胰腺癌中的表达水平高于正常胰腺组织。此外,c-MET表达水平与总生存率呈负相关。GEPIA和TCGA数据库分析显示,,c-MET 与 NRF2、SLC7A11等抗铁死亡指标呈显著正相关关系,表明c-MET参与了铁死亡抵抗的进程。
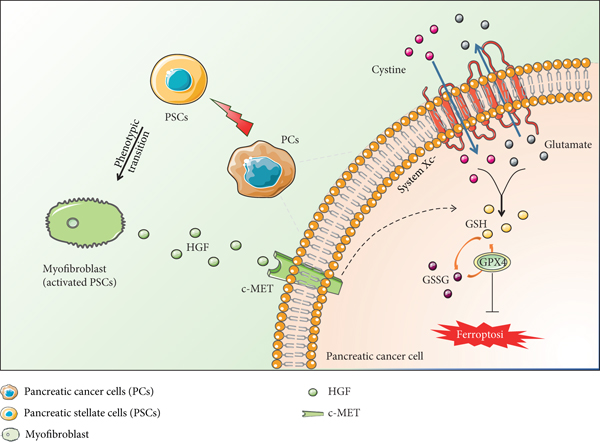
图4 活化的 PSCs 旁分泌 HGF 介导胰腺癌细胞铁死亡抵抗的机制示意图。
活化的PSCs可以分泌HGF,增强胰腺癌细胞的抗氧化能力,从而抵抗铁死亡。在这方面,HGF/c-MET轴在胰腺癌细胞防御铁死亡方面起着至关重要的作用。
综上所述,该研究表明胰腺癌细胞可以激活胰腺星状细胞,促进其HGF的分泌,增强胰腺癌细胞的抗氧化能力,介导胰腺癌的铁死亡抵抗力。它意味着一种潜在的治疗胰腺癌的选择,着眼于胰腺癌纤维化的微环境。然而,这一假设需要通过进一步的研究来证实,以更好地治疗胰腺癌。
参考文献:Wu Q, Song L, Guo Y, Liu S, Wang W, Liu H, Gong A, Liao X, Zhu H, Wang D. Activated Stellate Cell Paracrine HGF Exacerbated Pancreatic Cancer Cell Ferroptosis Resistance. Oxid Med Cell Longev. 2022 Jun 1;2022:2985249. doi: 10.1155/2022/2985249. PMID: 35693705; PMCID: PMC9177329.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35693705/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。