CD44 通过小 GTP 酶 RhoA 和 Rac1 介导体外血脑屏障模型中的剪切应力机械转导
最近的研究表明,血脑屏障(BBB)的完整性受血流施加的机械应力的调节。流体剪切应力和循环应变都会降低脑血管系统体外模型的渗透性。中枢神经系统(CNS)的细胞外基质(ECM)具有高浓度的蛋白聚糖和糖胺聚糖,特别是高分子量透明质酸(HMW-HA),并且缺乏身体其他部位常见的纤维状胶原蛋白。CNS 中血管系统和周围 ECM 的结构和功能的差异表明 BBB 中可能存在独特的机械转导机制。
先前的研究表明,高浓度的低分子量透明质酸,
在美国罗文大学生物医学工程系、密西西比大学医学中心药理学和毒理学系联合课题组的一项研究中探索了BBB内剪切力传导的成分,以更好地了解包括缺血性中风在内的与脑灌注变化相关的病理。

屏障功能需要一个剪切应力阈值
为了更全面地了解剪应力对屏障功能的影响,将一系列剪应力水平应用于3D BBB模型,为期4天。施加四种不同水平的剪切应力(静态控制,0.18、0.35、0.7和2.1 dyn/cm2),如图1 A(i-iii),来代表大脑血管系统中存在的剪切应力范围的下限。
图1 B-F显示了不同大小的流体剪切应力对体外血管内皮细胞形态和ZO-1(一种紧密连接相关的支架蛋白)定位的影响。培养4天后,静态血管(图1 B)表现出大量核周ZO-1染色,连接处定位不规则。暴露于低水平剪切应力(0.18和0.35 dyn/cm2)的血管具有类似的响应,分别如图1 C、D所示。相比之下,暴露于0.7和2.1 dyn/cm2的血管显示ZO-1在细胞-细胞连接处的定位增加(图1 E、F)。
TEER测量验证了剪切应力阈值的存在,暴露于0.7和2.1 dyn/cm2的血管中的屏障完整性显著增加(图1 G),其中2.1 dyn/cm2条件在第2天表现出明显增加的屏障完整性。渗透性测量还发现,与第4天的静态控制相比,暴露于0.7和2.1 dyn/cm2剪切应力的血管导致渗透性显著降低(图1 H)。这些发现进一步强调了流体剪切应力在脑血管系统屏障调节中的重要性。
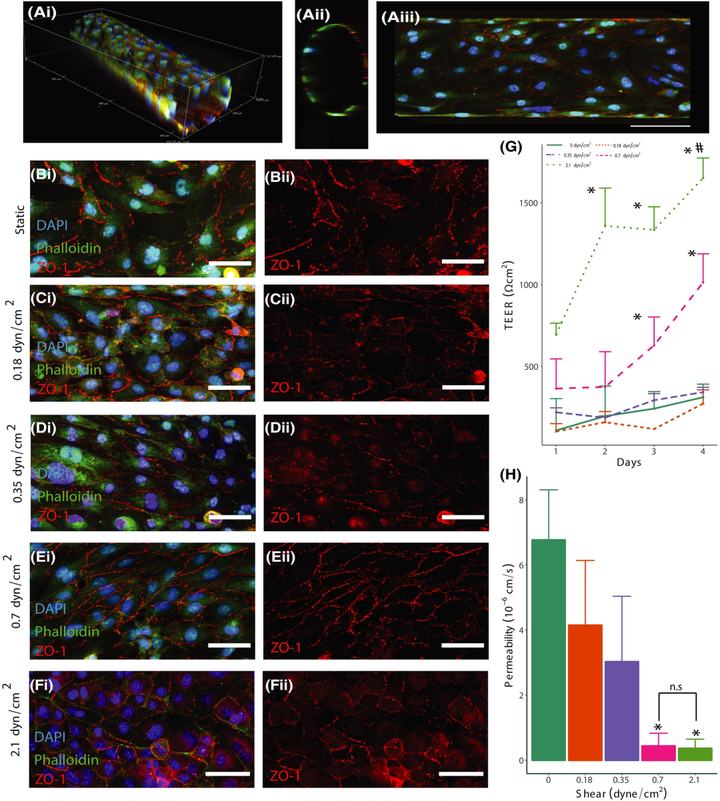
图1 流体剪切应力影响紧密连接和屏障完整性。
(A)hCMEC/D3 种子通道培养 4 天后的 3D的荧光图像(i)、横截面(ii)和x和y平面(iii)平面的最大投影图。(B)静态、(C)0.18 dyn/cm2、(D)0.35 dyn/cm2、(E)0.7 dyn/cm2、(F)2.1 dyn/cm2图像显示血管壁 DAPI(蓝色)、鬼笔环肽(绿色)和 ZO-1(红色)(在 ii 中分离)染色。(G)对暴露于静态或剪切条件 4 天的通道进行 TEER 测量。(H)使用 4 kDa 葡聚糖测量 4 天的静态或剪切条件下通道的渗透系数。
HMW-HA 增强屏障完整性
进行实验以确定流体剪切应力停止后屏障完整性的动态,以模拟急性缺血性中风期间脑血流的阻塞。在停止流动(时间= 0)并在20、60、120和240分钟评估渗透率之前,将血管暴露于0.7 dyn/cm2,即屏障形成所需的最小剪切应力水平4天。
如图2 A 所示,3D血管的渗透性在流出后的120和240分钟显著增加。如图2 A、B表明,在仅胶原蛋白水凝胶中制造的血管在初始测量时表现出显著更高的渗透性,并且在随后的4小时内渗透性没有显著变化。这些结果表明HA的存在有助于流动介导的屏障形成和维持。
因为CD44是HA的主要跨膜受体之一,所以对在胶原/HA和纯胶原支架中形成的血管进行免疫细胞化学,并暴露于4天的0.7 dyn/cm2剪切应力。图2 C-E提供了这些血管的图像,并显示在胶原蛋白/HA支架中 CD44在血管中的细胞-细胞连接处定位增加,而受体在整个细胞质中扩散,并且在纯胶原蛋白水凝胶中细胞-细胞连接处定位减弱。
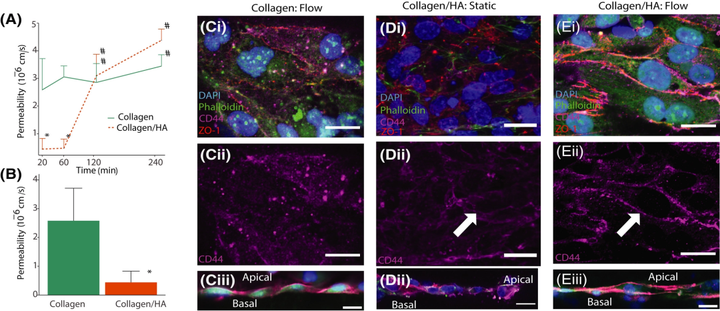
图2 ECM 成分影响屏障完整性和 CD44 定位。
(A)在灌注 4 天和流量停止 4 小时后进行的渗透率测量。(B)在胶原蛋白或胶原蛋白/HA 水凝胶中的通道灌注 4 天后,使用 4 kDa 葡聚糖测量的渗透系数。(C)CD44 在仅胶原水凝胶中的血管中的定位,并在血管壁(i 和 ii)和横截面(iii)中分别进行DAPI(蓝色)、鬼笔环肽(绿色)、抗 ZO-1(红色)和抗 CD44(洋红色)(在 ii 中分离)染色。(D)CD44 在静态条件下的胶原蛋白/HA 水凝胶中血管中的定位。(E)CD44 在暴露于流动的胶原蛋白/HA 水凝胶中血管中的定位。
CD44 表达和下游信号介导剪切应力转导
为了进一步探究CD44在机械转导中的作用,使用CRISPR/Cas9系统对hCMEC/D3细胞进行基因修饰,以敲除受体的表达。蛋白质印迹验证了基因编辑对CD44表达的影响(图3 A)。FITC-葡聚糖渗透性测定(图3 B)和每日TEER测量(图3 C)均表明,CD44表达的降低减轻了响应于0.7 dyn/cm2剪切应力的屏障的形成。用乱序引导序列处理的血管表现出ZO-1定位到细胞-细胞连接处,核周定位最小(图3 D-ii)。用CD44敲低细胞播种并暴露于流动的血管显示出ZO-1和 adducin-γ的细胞-细胞连接处的定位减少,adducin-γ蛋白是一种细胞骨架蛋白,广泛表达于血影蛋白-肌动蛋白连接处,将血影蛋白招募到肌动蛋白丝的末端(图3 D、E)。
鉴于先前的研究发现CD44激活会影响与细胞机械转导相关的小GTPase,因此使用ELISA测定法检查了暴露于 2.1 dyn/cm2剪切应力的血管中的乱序和敲除条件下的GTPase活性。与乱序对照相比,在CD44 KO血管中检测到显著升高的RhoA-GTP水平(图3 F)。相反,CD44 KO血管中Rac1-GTP水平降低(图3 G)。这些结果表明,CD44表达差异调节暴露于流体剪切应力的内皮细胞中的RhoA和Rac1激活。此外,3D BBB模型中的屏障形成需要CD44表达、ECM中的HA和流体剪切应力的组合。
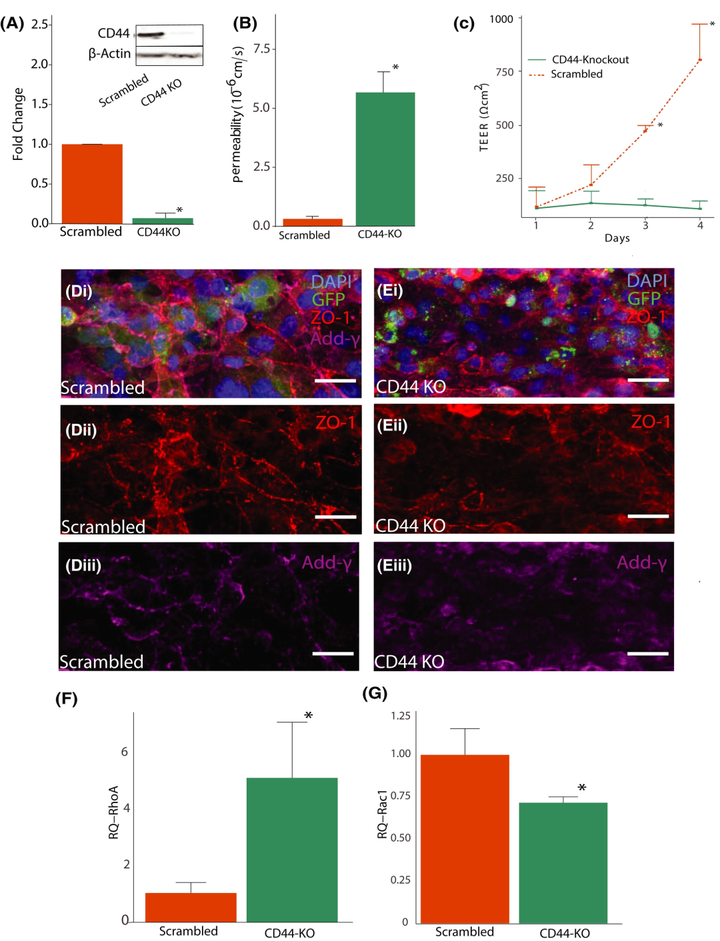
添加图片注释,不超过 140 字(可选)
图3 CD44 的表达调节屏障的形成。(A)CRISPR 修饰细胞中 CD44 和 β-肌动蛋白的蛋白质印迹。(B)培养 4 天后用转染细胞播种的通道的渗透系数。(C)在 4 天内针对不同条件进行的 TEER 测量。(D、E)在两种情况下用 DAPI(蓝色)、抗 ZO-1(红色)(在 ii 中分离)和抗adducin-γ(在 iii 中分离)染色的荧光图像:暴露于流动的胶原蛋白中的乱序对照细胞/HA 水凝胶(D)和暴露于流动的胶原蛋白/HA 水凝胶中的敲除细胞(E)。(F)用 ELISA 测量的通道中 RhoA 激活的相对强度(RQ)。(G)用 ELISA 测量的通道中 Rac1 激活的相对强度(RQ)。
RhoA 失活和 Rac1 激活增加屏障完整性以响应流动
已经证明CD44表达会在存在流体剪切应力的情况下改变RhoA和Rac1激活,因此进行了研究以直接评估剪切应力对小GTPase激活的影响。RhoA激活对BBB完整性的影响已被广泛研究,但脑内皮细胞中RhoA和Rac1活性的流动介导调节尚未阐明。
应用2.1 dyn/cm2显著降低了RhoA活性水平(图4 A)。使用大直径3D血管和ELISA测定法证实了这一结果(图4 B)。与静态对照相比,两种测定均表明减少了近50%。还对Rac1进行了ELISA,发现Rac1激活在灌注开始后的6小时和24小时时间点均显著增加(图4 C)。这些测定表明剪切应力导致RhoA和Rac1的差异表达,显著降低RhoA激活,同时增加Rac1激活。
为了验证小 GTPase 激活对于调节 180-µm 几何结构中屏障完整性的重要性,在停止流动之前用 Rho 抑制剂(C3 转移酶)处理血管 4 小时或在灌注 4 天的最后 4 小时用用 Rho 激活剂处理,剪切应力为 0.7 dyn/cm2。免疫细胞化学表明,调节 RhoA 激活对内皮细胞的形态有显著影响。图4 D 显示在存在 C3 转移酶的情况下,在 240 分钟无流动后,ZO-1 强烈定位到连接处。此外,小 GTPase 信号传导的下游靶点的 adducin-γ 也表现出对连接处的定位增加(图4 D-iii)。相反,在 4 天灌注期结束时,暴露于 Rho 激活剂会导致屏障破坏和 ZO-1 和 adducin-γ 的核周染色增加(图4 E )。如图4 F 所示,用 Rho 抑制剂灌注血管的 FITC-葡聚糖渗透性测试显示渗透性没有显著增加。相比之下,在 4 天灌注结束时,用 Rho 激活剂处理的血管的渗透性明显更高(图4 G)。
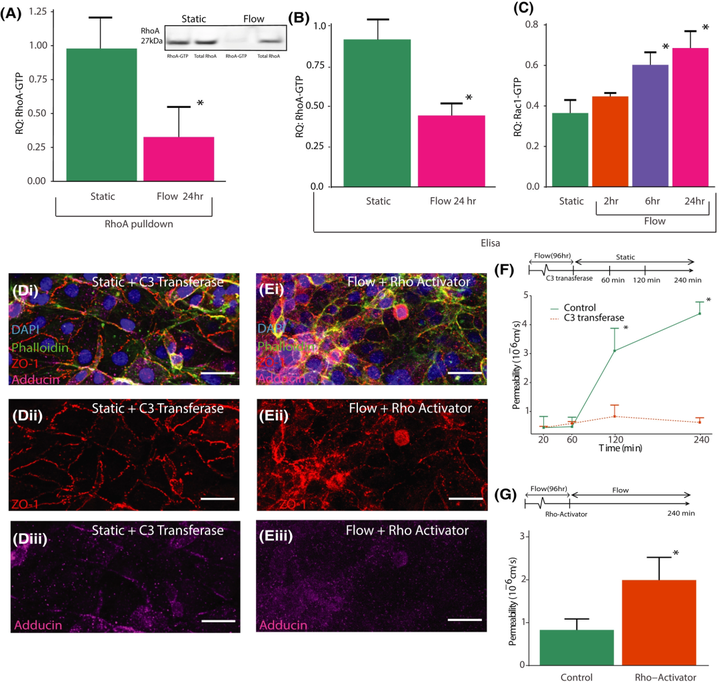
图4 流体剪切应力介导 Rac1 和 RhoA 激活。
(A)使用 Rhotekin 介导下拉分离的激活 RhoA 与总 RhoA 的相对强度。(B)使用 ELISA 测量的暴露于流量的通道中 RhoA 激活的相对强度。(C)使用 ELISA 测量的暴露于流量的通道中 Rac1 激活的相对强度。(D、E)C3 转移酶(D)和 Rho 激活剂(E)用 DAPI(蓝色)、ZO-1(红色)(在 ii 中分离)和adducin(洋红色)(在 iii 中分离)染色的血管的荧光图像。(F)灌注 4 天的通道的渗透系数,然后在流动停止前用 C3 转移酶孵育 4 小时。(G)灌注 4 天的通道的渗透系数,然后在流动停止前暴露于 Rho 激活器 4 小时。
Adducin-γ 定位是 Rac1 激活的下游效应
鉴于细胞-细胞连接的 adducin-γ 定位受 CD44 表达和 RhoA 抑制的影响,因此进行实验以确定这种蛋白对流动介导的屏障形成的重要性。以前的研究表明,adducin 有助于人上皮细胞的紧密连接稳定性,但尚未研究流体剪切应力对 adducin-γ 的影响。如图5 A、B 所示,与静态控制相比,暴露于 0.7 dyn/cm2的血管中,adducin-γ 在连接处的定位发生了变化。为了确定结合 adducin-γ 的紧密连接相关复合物是否响应流动形成,进行了 ZO-1 免疫沉淀。将 hCMEC/D3 细胞施加 0.7 或 2.1 dyn/cm2的稳定剪切应力。图5 C 显示,与静态对照相比,剪切应力的应用导致 ZO-1 免疫沉淀中的 adducin-γ 水平显著提高。
为了探究 BBB 形成过程中 adducin-γ 表达的重要性,在血管内播种之前,使用 siRNA 敲低 hCMEC/D3 细胞中蛋白质的信息水平(图5 D、E)。与乱序对照相比,含有敲低细胞的血管的渗透性测试表现出显著更高的渗透性(图5 F)。
总之,这些结果表明,adducin-γ 向细胞-细胞连接的募集是流体剪切应力作用于脑内皮细胞的一个一个不可或缺的下游结果,并且 CD44 表达和小 GTPase 活性都会改变其定位。
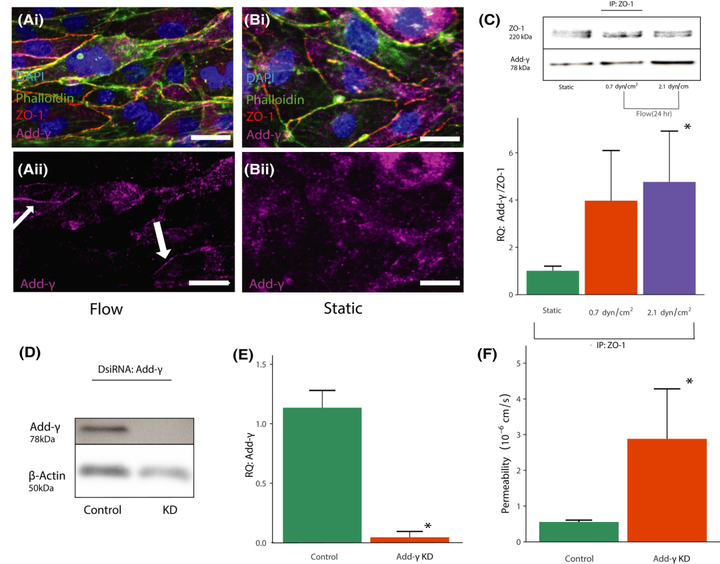
图5 Adducin-γ 通过与 ZO-1 结合来调节紧密连接的稳定性。
(A、B)用 DAPI(蓝色)、鬼笔环肽(绿色)、ZO-1(红色)和 add-γ (洋红色)(在 ii 中分离)染色的血管的荧光图像,,用于流动(A)和静态(B)条件。(C)从静态和流动条件的细胞中对 ZO-1 复合物进行免疫沉淀。(D)用靶向 add-γ 的 DsiRNA 处理的细胞的蛋白质印迹。(E)DsiRNA 和对照细胞中 add-γ 的相对强度归一化为 β-肌动蛋白。(F)在使用 add-γ 敲低 hCMEC/D3 细胞播种的通道中测量的渗透系数。
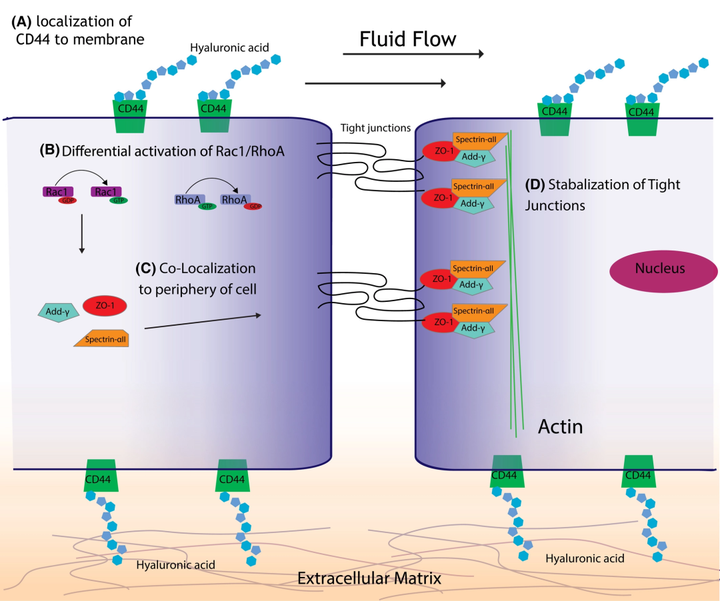
图6 机械敏感 CD44 通过激活 Rac1 和失活 RhoA 有助于稳定紧密连接。
(A)与 HA 结合的 CD44 可转换流体流动。(B)应用剪切应力激活 Rac1,同时使 RhoA 失活。(C)Rac1 的激活导致 add-γ 和 ZO-1 募集到细胞-细胞连接处。(D)add-γ 和 ZO-1 与 Spectrin-αII 形成结合复合物,稳定血脑屏障所需的紧密连接。
该研究结果表明,鉴于剪切应力水平<0.7 dyn/cm2不能显著增加灌注期间屏障的形成和维持,因此需要阈值水平的剪切应力来激活这一通路。此外,CRISPR 介导的对 CD44 水平的改变表明,所有三个成分:透明质酸、CD44 和剪切应力都是 3D BBB 模型中屏障形成所必需的。这项研究得出结论,这种机制是 BBB 机械传导的组成部分,确定了脑血流施加的剪切应力的替代机械感觉复合体。
参考文献:DeOre BJ, Partyka PP, Fan F, Galie PA. CD44 mediates shear stress mechanotransduction in an in vitro blood-brain barrier model through small GTPases RhoA and Rac1. FASEB J. 2022 May;36(5):e22278. doi: 10.1096/fj.202100822RR. PMID: 35436025.原文链接:https://pubmed-ncbi-nlm-nih-gov.proxy.library.carleton.ca/35436025/图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养的知识吧!