抗白血病作用与共培养中受刺激的巨噬细胞下调 CD47 和上调 CRT 相关
急性髓系白血病(AML)是一种侵袭性恶性肿瘤,预后一般较差,5 年生存率约为 27%。因此,有必要探索 AML 的其他治疗方案,以提高生存率并改善总体预后。
肿瘤免疫监视是免疫系统根据肿瘤特异性抗原在其表面的表达来识别和消除肿瘤细胞的一种方式。巨噬细胞是参与肿瘤消除的主要细胞,在调节肿瘤发病机制中发挥重要作用。此外,巨噬细胞通过产生细胞因子和吞噬作用介导肿瘤细胞消除。AML可以通过上调CD47来逃避巨噬细胞的吞噬作用。
巨噬细胞的吞噬活性可以通过抑制CD47或激活钙网蛋白(CRT)来调节。CD47是一种跨膜糖蛋白,起抑制信号的作用,通过与巨噬细胞表面的信号调节蛋白α(SIRPα)结合来抑制吞噬作用。许多研究报告称,在包括AML在内的多种癌细胞中阻断CD47表达会导致巨噬细胞吞噬肿瘤细胞。CD47的阻断可能导致CRT水平升高,这是巨噬细胞识别所必需的,因此会触发CRT介导的吞噬作用。
越来越多的证据表明,由脂多糖(LPS)和其他促炎细胞因子(如IFN-γ)激活的M1巨噬细胞可杀死肿瘤细胞,抑制血管生成,并通过巨噬细胞消除癌细胞来改善预后。许多研究报告了使用体外诱导的巨噬细胞模型消除癌细胞。然而,与这种诱导相关的重要免疫参数,特别是在AML中,仍未完全阐明。
基于此,加拿大国家研究委员会计量研究中心、多伦多大学化学工程系、西奈山医学院病理学和检验医学系的联合团队使用人类巨噬细胞和癌细胞共培养证明了一种同时抑制CD47和提高CRT表达水平以消除AML的新模型,并使用不同浓度(0–100 ng/mL)的LPS 评估了几个免疫反应参数和相关的生物标志物表达。该研究结果为筛选抗AML药物提供了一种新的共培养方法。

共培养时在 HL-60 白血病细胞上同时下调 CD47 和增加 CRT 表达
在这项研究中,假设白血病细胞中CD47表达的下调可以增加共培养中巨噬细胞对它们的消除。为了验证这一假设,人类HL-60细胞(人早幼粒急性白血病细胞)首先与THP-1巨噬细胞在配对室中共培养(图1 a ),将0、5、20和100 ng/mL的LPS添加到含有THP-1巨噬细胞的底部室中,并孵育16-18小时,然后评估共培养后HL-60上的CD47和CRT水平。
如图1 b所示,HL-60上的CD47水平随着用于刺激THP-1巨噬细胞的LPS量(ng/mL)的增加而降低(图1 b)。令人惊讶的是,HL-60上的CRT水平也随着LPS剂量的增加而增加(图1 c)。THP-1巨噬细胞的刺激导致CD47的下调,有趣的是它增加了HL-60细胞表面的 CRT水平。CD47水平在0 ng/mL LPS时最高,相反CRT水平在0 ng/mL LPS时最低(图1 b、c)。在用于刺激与HL-60细胞共培养的THP-1巨噬细胞的所有LPS浓度下都可以看到这种模式(图1 b、c)。CD47水平在100 ng/mL LPS下显示81%的下调,在5-20 ng/mL LPS下显示32-77%的下调(图1 b)。
其次,检查CD47的下调是否发生在正常血细胞中。PBMC(外周血单个核细胞)正常血细胞在与HL-60相同的条件下与分化的THP-1巨噬细胞共培养并用作对照(图1 b)。PBMC在所有使用的LPS浓度(包括0 ng/mL)下表现出相似的低CD47表达水平(图1 d)。CRT水平观察到类似的结果(图1 e)。在 LPS 刺激后与 THP-1 巨噬细胞共培养和单独培养时,在任何浓度的 LPS 作用下 PBMC 正常细胞中均未见 CD47 下调或 CRT 升高(图1 d、e)。这些结果表明,巨噬细胞样细胞的激活和随后CD47的抑制和CRT水平的增加可能仅对癌细胞具有选择性,并且可以在不同浓度的激活材料下逐渐应用。此外,CD47的抑制和CRT水平的诱导只能在共培养中获得,表明该模型具有指导白血病治疗发展的潜力。
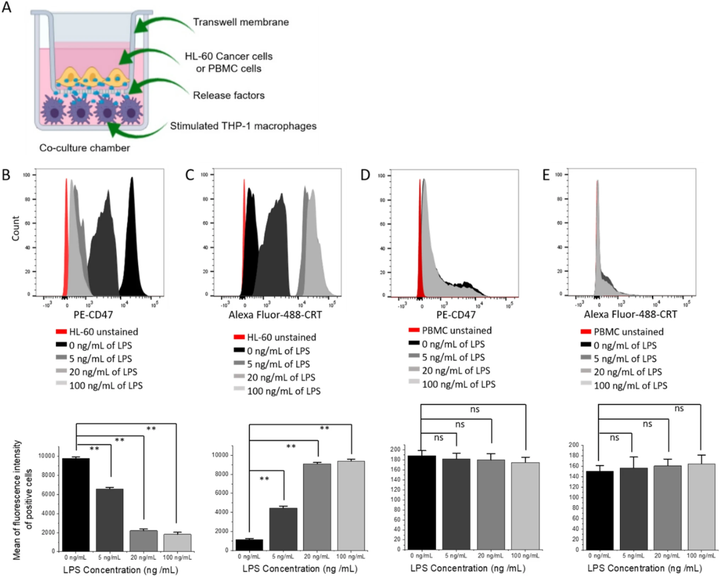
图1 与受刺激的 THP-1 巨噬细胞共培养后,HL-60 和 PBMC 中的 CD47 和 CRT 水平。(a)THP-1 巨噬细胞与 HL60 或 PBMC 在共培养室中共培养的方案。流式细胞仪分析 HL-60 细胞中的 CD47(b)和 CRT(c);与 THP-1 巨噬细胞共培养后,PBMC 细胞中的CD47(d)和 CRT(e)。
共培养中激活 THP-1 巨噬细胞对 HL-60 的消除和细胞活力
在共培养中,LPS用于激活THP-1巨噬细胞,并与HL-60白血病细胞一起孵育过夜。因此,有必要在共培养前研究LPS对HL-60和PBMC活力的影响。此外,为了进一步检验之前的假设并研究巨噬细胞对癌细胞的消除,测定了与巨噬细胞共培养后HL-60和PBMC(作为对照)的细胞凋亡率。
结果表明,当这两种细胞系单独培养并用LPS处理时,HL-60和PBMC的活力在所有LPS浓度下在16-18小时的孵育期间保持在90%以上。然而,在与THP-1巨噬细胞共培养后,随着LPS浓度的增加,观察到细胞凋亡增加(图2 a、c)。HL-60细胞的凋亡从5 ng/mL LPS时的22%增加到100 ng/mL LPS时的77%(图2 a、c)。然而,与0 ng/mL LPS相比,PBMC在任何LPS浓度下都没有显示出任何显著的细胞凋亡增加(图2 b、c)。上述结果表明,由于LPS激活,巨噬细胞对癌细胞的消除具有选择性,并且共培养模型是这种癌细胞消除发生所必需的。
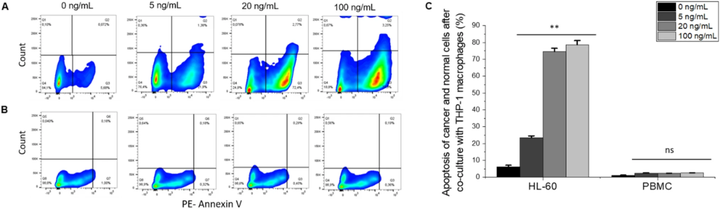
图2 LPS 激活的 THP-1 巨噬细胞在共培养中消除 HL-60。HL-60(a)和 PBMC(b)的侧散点图。所有图均显示在 0、5、20 和 100 ng/mL LPS 时发生的细胞凋亡。(c)显示与 THP-1 巨噬细胞共培养后癌细胞和正常细胞凋亡的百分比。
共培养中 LPS 激活的 THP-1 巨噬细胞上 CRT 和 CD14 水平升高
实验进一步研究了LPS激活的巨噬细胞上CRT和CD14的水平及其与吞噬作用的联系。实验注意到,癌细胞上生物标志物表达的改变只发生在与巨噬细胞的共培养中(图3)。这可能是它们通过CRT介导的吞噬作用消除的原因。当与HL-60和THP-1癌细胞共培养时,THP-1巨噬细胞显示出最高水平的CRT(图3 a-c、k)。当THP-1巨噬细胞与NB4(急性早幼粒白血病细胞)共培养时,CRT水平相似,而与PBMC共培养时,CRT水平较低(图3 d、e、k)。这里需要注意的是,THP-1巨噬细胞(与癌细胞共培养时)上的CRT水平显著高于 与PBMC正常细胞共培养后获得的CRT水平(图3 k),表明在共培养中THP-1巨噬细胞发生了更高水平的CRT改变,最终导致与巨噬细胞共培养时发生吞噬作用和消除癌细胞。
已知CD14参与LPS的结合和随后产生的促炎反应。在实验结果中,当与HL-60和NB4共培养时,LPS激活的THP-1巨噬细胞确实显示出高水平的CD14(图3 f-h、l)。在与PBMC正常细胞共培养后,THP-1巨噬细胞上其表达水平较低(图3 j、l)。上述所有癌细胞均单独培养并用0、5、20和100 ng/mL的LPS处理,之后通过流式细胞术测量其表面的CD14。在5 ng/mL LPS处理后,HL60和NB4癌细胞上的CD14水平没有显著增加。对于THP-1癌细胞和PBMC正常细胞,CD14在所有浓度下的增加均不显著。在20和100 ng/mL LPS处理时,HL60和NB4上CD14水平显著增加,然而,当与THP-1巨噬细胞共培养时,所有细胞系细胞上的CD14水平显著升高(与单独培养的水平相比,图3)。类似地,单独培养时THP-1巨噬细胞上的CD14水平随着LPS浓度的增加而增加,但这些增加的水平远低于THP-1巨噬细胞与癌细胞共培养后增加的CD14水平(图3 l)。这些证据表明,CRT介导的巨噬细胞消除癌细胞可能发生在共培养中。
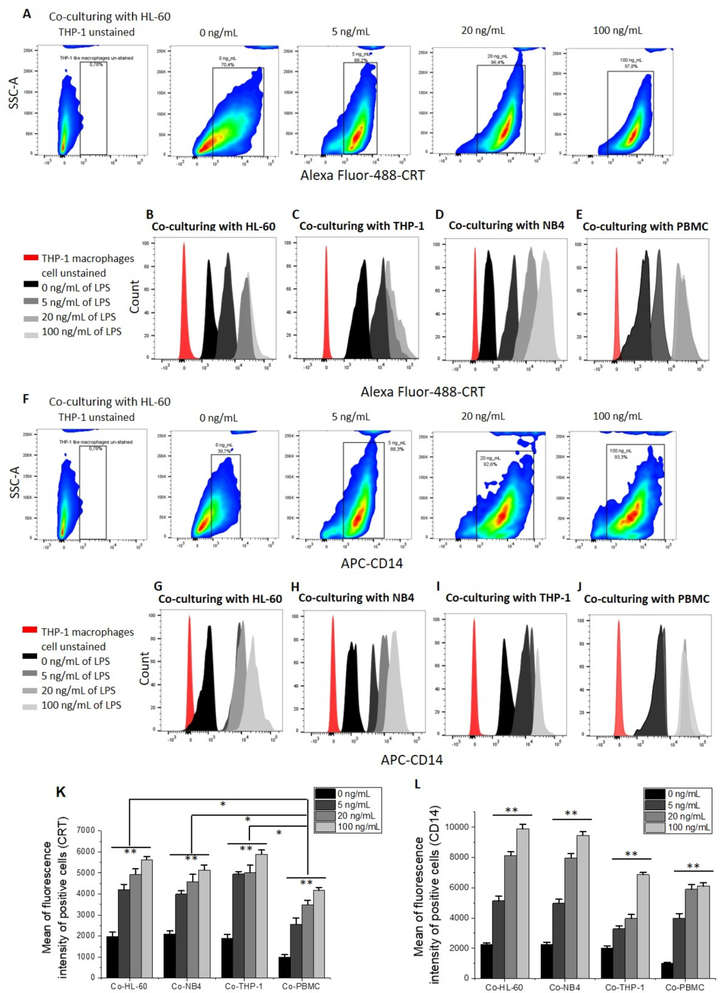
图3 与白血病细胞共培养后,THP-1 巨噬细胞上 CRT 和 CD14 水平升高。侧散点图的代表性示例显示,在与 HL-60 共培养,当用 0、5、20 和 100 ng/mL 的 LPS 激活时,THP-1 巨噬细胞上的 CRT(a)和 CD14(f)水平增加。流式细胞仪直方图显示当用 0、5、20 和 100 ng/mL 的 LPS 激活,与 HL-60(b、g);THP-1癌细胞(c、i);NB4(d、h)和PBMC正常细胞(e、j)共培养时,THP-1巨噬细胞上的CRT(b-e)和CD14(g-j)水平。与 HL-60、NB4、THP-1 癌细胞和 PBMC 正常细胞共培养后 THP-1 巨噬细胞上CRT(k)和 CD14(l)的水平。
LPS 激活 THP-1 巨噬细胞后 M1 巨噬细胞极化相关细胞因子水平升高
据报道,各种CD47抑制方法(包括使用LPS激活巨噬细胞)会导致某些细胞因子的产生增加并刺激吞噬作用。在该研究中,不同浓度的 LPS用于刺激THP-1巨噬细胞。结果,CD47在所有使用的白血病细胞系中都被下调。实验还发现,与对照相比,LPS刺激以剂量依赖性方式导致IL-12p70、IL-6、TNF-α、IL-1β、IL-10和IL-8的显著产生(图4)。当THP-1巨噬细胞在100 ng/mL LPS下被激活时,IL-12p70比对照(0 ng/mL LPS)高30倍(图4 a)。在与对照相同的LPS浓度下,IL-6和TNF-α随后增加超过20倍(图4)。上述所有细胞因子都是由M1型巨噬细胞分泌的,主要是LPS刺激的结果。共培养培养基上清液中这些细胞因子的高水平存在表明 THP-1 巨噬细胞为M1型,其主要作用是消除癌细胞。这些结果是支持实验假设的另一个证据,即在LPS刺激共培养中的巨噬细胞时,CD47和CRT水平发生变化以标记癌细胞被M1巨噬细胞消除。这在之前的 CD47 和 CRT 水平的改变以及癌细胞的消除(细胞凋亡)中得到了证明。
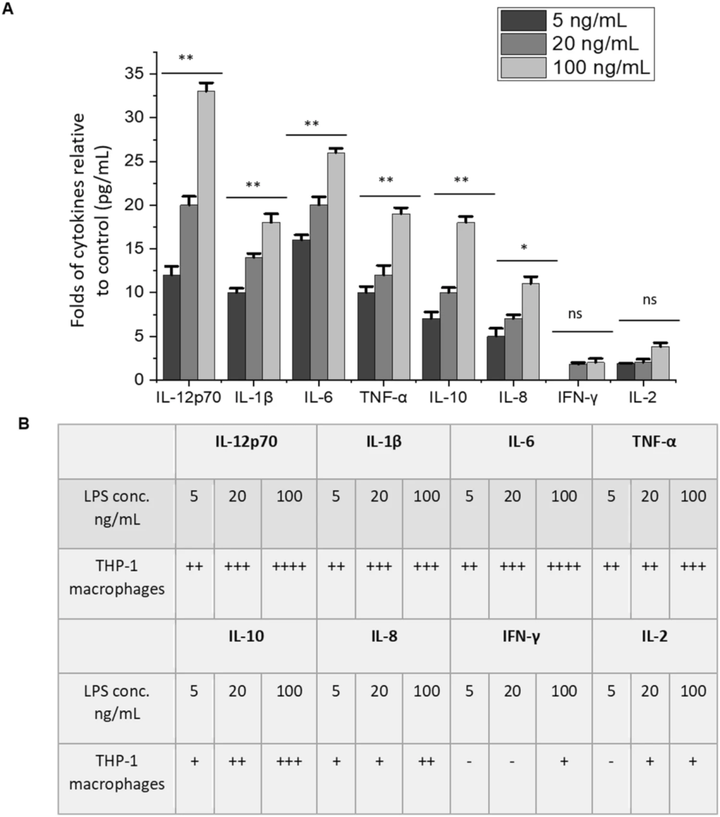
图4 LPS 激活 THP-1 巨噬细胞后 M1 巨噬细胞极化标志物水平升高。(a)在 0、5、20 和 100 ng/mL LPS 激活后,相对于 THP-1 巨噬细胞对照(0 ng/mL LPS)产生的细胞因子水平(pg/mL)。(b)THP-1 巨噬细胞中细胞因子水平相对于对照的倍数变化。
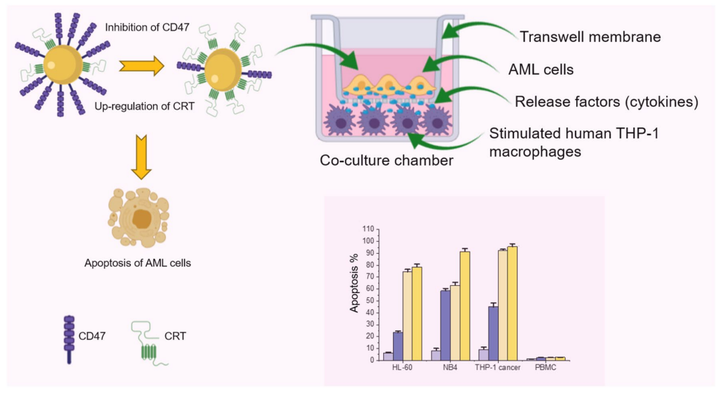
图5 图形概要
总之,该研究结果表明,在共培养中成功使用人类巨噬细胞模型在 AML 癌细胞中抑制 CD47 并上调CRT 从而增加它们的消除。此外,数据表明该模型对 AML 细胞具有选择性,并且不影响其他几种类型的正常血细胞,这表明该模型在筛选抗 AML 新药方面的潜力,以及未来在 AML 治疗中使用人类巨噬细胞的可能性。