应变下的NSCs —— 揭示分化星形胶质细胞在与分化神经元在循环应变共培养中的机械保护作用
神经干细胞(NSC)是中枢神经系统中所有神经元和神经胶质细胞的来源。NSCs 感知位于其特殊细胞外环境(称为神经干细胞生态位)中的化学和机械线索。在这种特殊的微环境中,NSCs 和祖细胞由许多调节干细胞特性的细胞外信号提供。
由于血液脉动,脑组织持续运动,组织变形幅度接近高达 30%。因此,虽然经常被忽视,但无处不在的机械线索会影响生态位,例如周围微环境的刚度或或由于微环境的复杂结构及其相互连接的细胞外蛋白质网络而产生的管状结构网络。Arumoli 及其同事曾报告了应变作为影响 NSCs 的机械线索。此外,脉动血管施加的机械应变可能会对 NSCs 产生实质性的影响。研究表明,机械因素本质上影响分化模式和细胞系定型。然而,关于循环应变作为 NSCs 命运线索的作用知之甚少。
德国 Juelich 研究中心及科隆大学医学院研究团队之前的实验表明,这种脉动运动可以通过在可拉伸弹性体上培养的细胞来在体外进行模拟。使用该系统,循环拉伸的神经元在垂直于单轴应变的方向上生长。这种细胞重新定向是大多数哺乳动物细胞在拉伸时的特征反应。值得注意的是,循环拉伸诱导神经元分支的生长,表明机械应变参与了其发育过程。在后期的一项研究中,该团队进一步探讨了循环单轴应变对原代大鼠 NSCs 及其后代的影响。相关研究成果发表在 Frontiers in Cellular Neuroscience 期刊题为“NSCs Under Strain—Unraveling the Mechanoprotective Role of Differentiating Astrocytes in a Cyclically Stretched Coculture With Differentiating Neurons”。
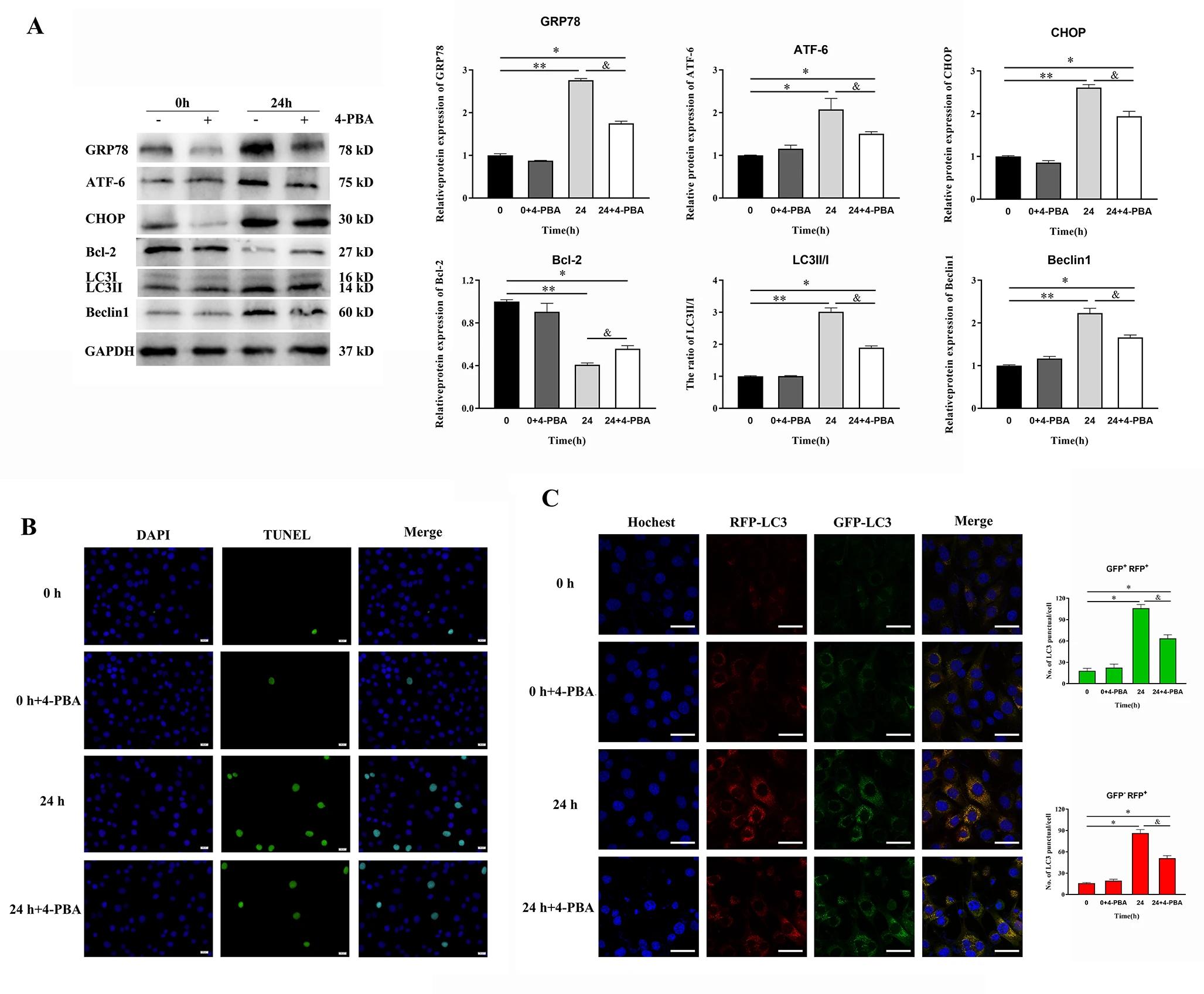
由于迁移细胞(如NSCs)的高细胞动力学,研究人员怀疑循环底物应变会在多大程度上使生长在弹性体顶部的 NSCs 变形,利用自制的基于交联聚二甲基硅氧烷(PDMS)弹性体拉伸系统,腔室以 15% 的振幅和 300 mHz 的频率单轴拉伸(这种拉伸方案已被证明可以诱导皮质神经元的明确机械反应)。首先检测对循环应变的即时反应,通过活细胞显微镜观察 NSCs 的机械变形。振幅逐步增加 4%,直到应变的 28%,并在释放位置再次成像(图1 A)。底物应变使神经元胞体细胞和 NSCs 的突起均发生变形,而且沿着拉伸方向排列的细胞过程跟随底物拉伸(图1 B),而垂直于拉伸方向的细胞过程没有发生明显的伸长。在施加28%的底物应变后,NSCs 显示细胞体拉伸 25.5%(图1 C)。NSCs 不会受到底物变形的负面影响,因为根据碘化丙啶评估它们不会收缩并且保持活力(图1 D、E)。

图1 NSCs遵循底物变形,不受循环应变的影响。
接下来,研究了循环机械应变对 NSCs 特征功能的影响,即增殖,分化和谱系决定(lineage commitment)。与未拉伸对照相比,在有丝分裂原 FGF 存在下循环拉伸24小时显著降低了 NSC 的增殖率。然而,有丝分裂原停用后5天开始分化的谱系决定并没有被整个时间内应用的循环机械拉伸所改变。此外,用干性标记物 Sox2 染色证明,有丝分裂原停用5天后的循环拉伸不影响仍未分化的 NSCs 的百分比,这表明这种机械刺激既不影响 NSC 分化的速度,也不影响 NSC 分化的命运。
虽然大多数哺乳动物细胞大致垂直于单轴循环应变排列以减少其机械应力,但在这里首次发现 NSCs 平行于拉伸方向排列(图2 A-C)。NSCs 的细胞骨架丝在细胞内具有不同的空间分布,导致其对应变有明显的重定向模式(图2 B)。然而,肌动蛋白更多地定位于外周部分和细胞突起,只有适度的重新排列。有趣的是,实验没有观察到任何应力纤维的形成,肌动蛋白细胞骨架分布在拉伸组和对照组中相似。总的来说,细胞骨架标记在暴露于循环拉伸24小时后显示出平行于应变的重新定向(图2 C)。通过半定量分析,发现拉伸 NSC 中微管蛋白和巢蛋白染色的图像强度增加,这表明拉伸诱导了两个细胞骨架系统的细胞骨架增强(图2 D)。
 图2 神经干细胞在应变和细胞骨架重分布下的重定向。
图2 神经干细胞在应变和细胞骨架重分布下的重定向。
由于 NSCs 在拉伸方向上重新定向,因此接着研究了 NSCs 在分裂原退出诱导的分化过程中如何对应变作出反应。与未分化的 NSC 类似,NSC 衍生的年轻星形胶质细胞平行于循环应变排列。在分化过程中拉伸的星形胶质细胞与未拉伸的对照细胞相比,GFAP(胶质纤维酸性蛋白)排列明显向应变方向转移。相比之下,NSC 衍生的年轻神经元没有显示出任何重新定向。
为了研究这种重新定向行为是否是星形胶质细胞分化的一个主动的、持续的过程,在拉伸3天后将单轴应变的方向旋转90°,这是一个已经可以看到定向生长的时间点。旋转人为地迫使星形胶质细胞向远离拉伸的方向运动。然而,持续2天的循环拉伸恢复了星形胶质细胞的平行方向,强调了应变方向的排列特征是年轻星形胶质细胞对循环应变的稳定和积极的机械反应。这表明,神经干细胞分化过程中的循环应变在神经表型缺乏机械反应的情况下使星形胶质细胞向拉伸方向重新定向。
细胞与应变的平行排列先前被描述为依赖于 GTPase RhoA 的激活,并且与内皮细胞和骨肉瘤细胞中缺乏应力纤维有关。由于观察到 NSCs 中缺乏中心应力纤维,因此假设 NSCs 中缺乏收缩性可能是导致这些细胞在最大机械负荷方向排列的原因。为了验证这一假设,通过溶血磷脂酸(LPA)激活 RhoA 来增加 NSCs 的收缩性,并观察到 NSCs 中中心应力纤维的清晰形成与应变无关。此外,在拉伸应用后,应力纤维诱导显著降低了 NSCs 在最大机械负荷方向的定向行为,从而降低了之前发现的 NSCs 的机械响应。
相反,应力纤维存在于产后星形胶质细胞中。与未拉伸的细胞相比,拉伸后在垂直方向上可以检测到轻微的重新定向,值得注意的是,星形胶质细胞的 GFAP 细胞骨架不受循环拉伸的影响。在24小时的拉伸后,它没有显示出任何定向方向,导致出生后星形胶质细胞随机分布的长细胞形状。
为了进一步阐明星形胶质细胞和神经元之间以及分化阶段观察到的差异,最后,进一步评估了星形胶质细胞/神经元共培养中不同细胞比例对循环应变的反应(图3 A、B)。虽然分离的神经元与应变垂直排列(图3 B、C),但共培养中神经元的重新排列取决于星形胶质细胞的比例(图3 B)。随着星形胶质细胞数量的增加,在相同数量的星形胶质细胞时(1:1),神经元的排列不断减少,导致神经元细胞的随机定向。然而,当共培养的星形胶质细胞较少时(4:1),神经元细胞保持其机械反应,相对于应变保持垂直方向排列。共聚焦显微镜和3D重建显示,混合培养中皮层神经元在产后星形胶质细胞上生长(图3 D)。这些数据不仅证实了之前显示的星形胶质细胞和神经元分化的协同细胞生长,而且还证明了星形胶质细胞对分化的神经元具有机械保护功能。
实验在 LPA 存在下的神经元拉伸实验以及神经元和星形胶质细胞的共培养中进一步分析了这一假设。这些数据证实了纯神经元相对于拉伸在垂直方向上的重新定向。有趣的是,即使 RhoA 被激活,星形胶质细胞以1-1的比例存在也保留了它们对神经元的机械保护作用。如果 RhoA 在整个24小时的拉伸时间内或仅在拉伸的最后40分钟被激活,这种效果保持稳定。
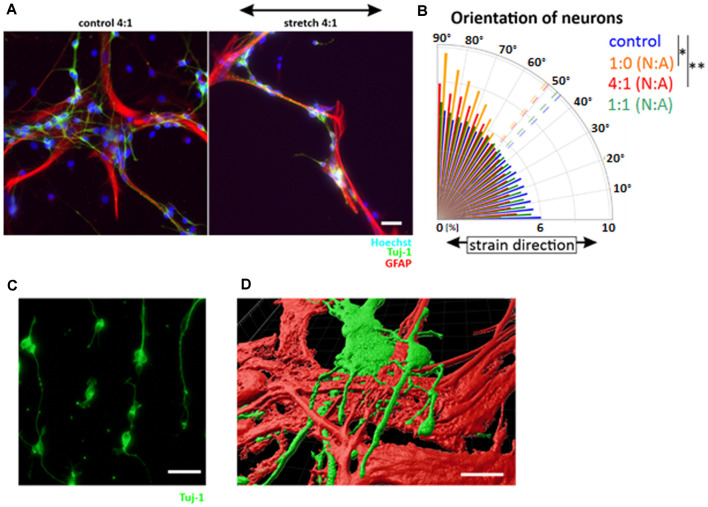 图3 产后星形胶质细胞的机械保护作用。
图3 产后星形胶质细胞的机械保护作用。
总之,这些发现可能突出了星形胶质细胞在清除对神经元表型的机械影响方面的重要作用及其提出的机械保护功能。这种机制保护与星形胶质细胞支持、引导和促进神经元生长的作用相吻合。此外,星形胶质细胞与血管密切相互作用,甚至调节血流和血管直径,从而可能缓冲脑血管系统的机械负荷。该研究结果强调了机械力对发育和成体阶段基本脑细胞特性的重要性,并深入了解了神经源性生态位中 NSCs 行为的复杂但未知的机制。
参考文献:Abraham JA, Blaschke S, Tarazi S, Dreissen G, Vay SU, Schroeter M, Fink GR, Merkel R, Rueger MA, Hoffmann B. NSCs Under Strain-Unraveling the Mechanoprotective Role of Differentiating Astrocytes in a Cyclically Stretched Coculture With Differentiating Neurons. Front Cell Neurosci. 2021 Sep 24;15:706585. doi: 10.3389/fncel.2021.706585. PMID: 34630042; PMCID: PMC8497758.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34630042/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
Naturethink牵张力|拉伸力|细胞拉伸|细胞牵张|细胞牵张应变|牵张应变细胞培养仪