基质刚度和拉伸调节肺动脉外膜成纤维细胞的促纤维化机械信号
肺动脉外膜成纤维细胞(PAAFs)对血管细胞外基质(ECM)稳态和重塑很重要,有证据表明PAAFs受基质刚度、拉伸应力或过度拉伸损伤和缺氧的调节。在损伤期间,PAAFs被激活并分化为肌成纤维细胞亚型,通过直接改变ECM蛋白(包括胶原蛋白,纤连蛋白和弹性蛋白)的表达、降解或交联来重塑血管壁特性。鉴于ECM也可作为细胞粘附的基质,并发送决定细胞表型的物理和化学线索,因此有人认为基质变硬可能预示着组织重塑,并且是肺动脉高压的致病驱动因素。
肺动脉高压(PAH)是一种血管病变,表现为肺动脉压持续升高、血管收缩和不可逆的血管重塑。肺动脉壁外膜中的PAAFs对变化的机械条件和功能作出反应,重塑ECM,从而调节其机械特性。虽然成纤维细胞活化诱导血管胶原基质的组成和结构发生变化,但尚不清楚PAAFs如何受到基质组成和刚度的调节,如何受到PAH期间负荷增加引起的血管拉伸改变的影响,以及哪些信号通路调节这些对物理刺激的表型反应。
为了更好地识别PAH期间调控PAAFs反应的受体和通路,美国加州大学圣地亚哥分校生物工程系的研究团队曾构建了PAAFs的机械信号模型,并对不同刚度凝胶和不同拉伸条件下培养的PAAFs进行了体外实验,以确定六个促纤维化基因对模拟PAH轻度和重度阶段的拉伸和刚度变化的反应。该分析表明,细胞拉伸和ECM刚度变化差异激活的通路可能有助于阐明PAAFs中组织重塑的顺序。相关内容发表在 CELLS期刊题为“Substrate Stiffness and Stretch Regulate Profibrotic Mechanosignaling in Pulmonary Arterial Adventitial Fibroblasts”。

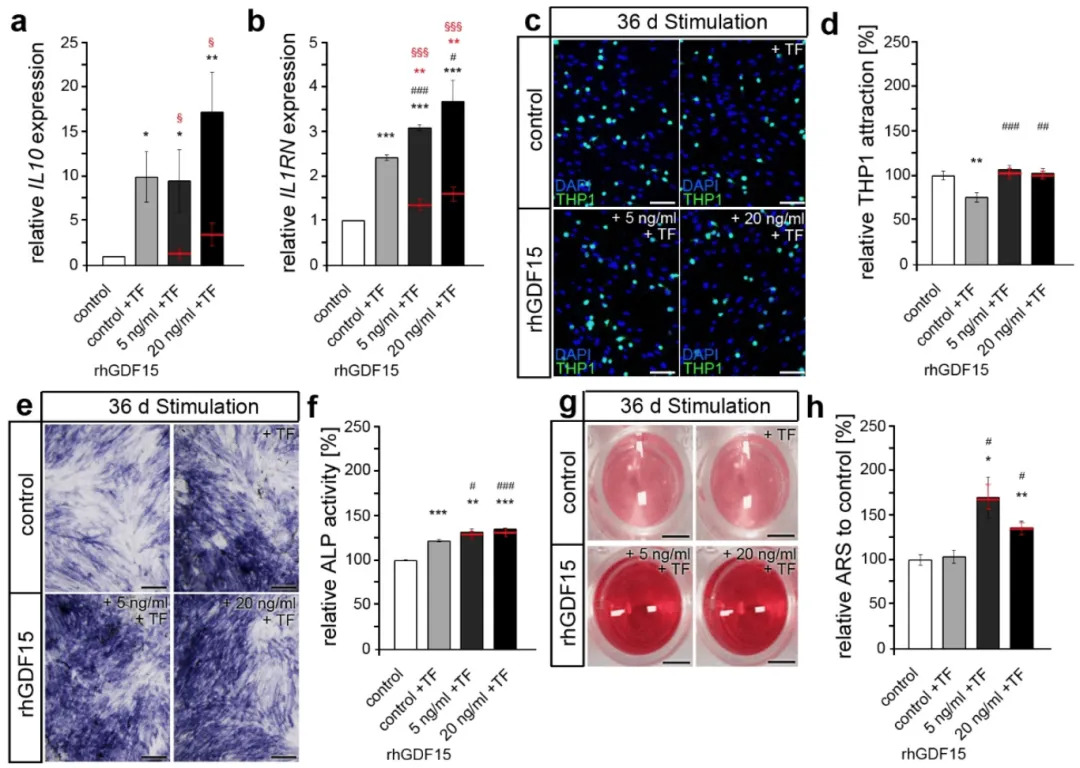
PAAFs 上调促纤维化基因以响应基质刚度和拉伸增加
实验使用对应于正常血压的肺动脉(0.5 kPa)、轻度PAH(3 kPa)和重度PAH(10 kPa)的硬度制备聚丙烯酰胺水凝胶,模拟体内不同阶段的物理基质刚度。PAAFs在0.5 kPa刚度6孔板上培养三天后从肌成纤维细胞恢复为成纤维细胞表型,与在较硬的基质上生长的细胞相比,Acta2的表达降低,培养时呈圆形(图1 B),而在较硬的基质上生长的细胞则呈星状,Acta2表达较高(图1 C、D)。在0.5 kPa底物上培养的成纤维细胞中Col1a1,Col3a1,Eln,Fn1,Loxl1和Acta2基因的信使RNA水平与从正常血压大鼠的肺动脉外膜中提取的RNA水平没有显著差异(图1 A)。这表明,在0.5 kPa基质上培养的细胞可以模拟以下研究中六个基因在体内PAAFs中的表达。
与在0.5 kPa底物上培养的PAAFs中的mRNA水平相比,六个基因均响应基质刚度的增加而显著上调。Acta2和Loxl1的表达在3 kPa基质生长的细胞上明显更高,但在10 kPa基质生长的细胞上不显著,与0.5 kPa基质相比(图1 A),Col1a1、Col3a1、Eln和Fn1在10 kPa基质上显著上调(与晚期PAH中的动脉硬度相当)。有趣的是,Acta2和Loxl1的表达表现出非单调效应,与0.5 kPa基质相比,3 kPa基质上的基因表达显著上调,但在0.5 kPa和10 kPa基质上培养的细胞之间没有显著差异。

图1 基质刚度对肺动脉内皮成纤维细胞(PAAF)分化的影响。
检查六个基因在10% 等双轴拉伸24小时的PAAFs中的转录反应(图2 A-F),与未拉伸细胞相比,Col1a1、Col3a1、Eln、Loxl1 和 Acta2 显著上调,而不依赖于基质刚度。 虽然Fn1表达在拉伸24小时后没有显著变化(图1 A),但在所有凝胶刚度下,Fn1表达在4小时后都显著上调。另一方面,Col1a1仅在拉伸24小时后显着上调,但在4小时后没有。这表明Fn1是由短时间的拉伸短暂诱导的,而Col1a1对拉伸的反应要慢得多。这一发现与将Fn1确定为早期反应基因的报道一致。在六个基因的表达中没有发现基质刚度和拉伸之间的显著交互作用。
根据事后测试,在3 kpa和10 kpa时,ECM刚度的增加显著上调了III型胶原蛋白和平滑肌肌动蛋白(SMA)的表达。这与胶原蛋白III(Col3a1)和SMA(Acta2)的RNA相对表达一致,如图1 B、F,从0.5 kPa-3 kPa 显著增加,而从3 kPa-10 kPa没有进一步显著增加。
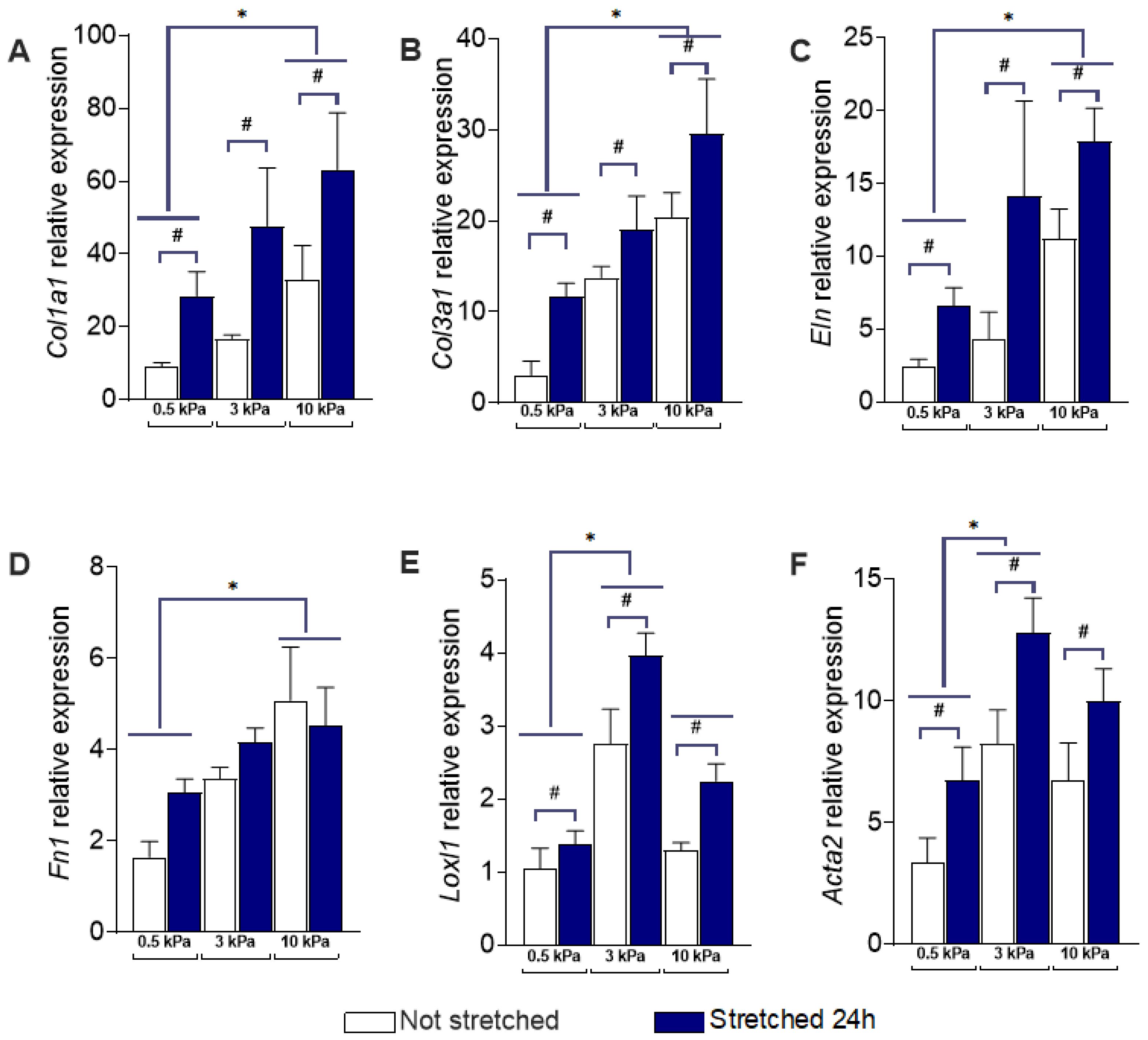
图2 刚硬和拉伸对肺动脉内皮成纤维细胞(PAAFs)基因表达的影响。
PAAF网络模型模拟刚度和拉伸激活的基因表达
该模型预测,基质刚度从0.5 kPa增加到3或10 kPa 时,所有六个基因都会显著上调(图3)。这些模型的预测与实验观察结果相符,即所有六个基因在较硬基质上生长的细胞中都显著上调。
该模型还预测了在 10% 等双轴拉伸诱导24小时后,Col1a1,Col3a1,Loxl1和Acta2的基因表达上调,Fn1表达恢复到基线水平。然而,该模型预测Eln表达随拉伸而下调,而实验结果显示上调。虽然该模型与数据在定性上一致,但它并没有概括Loxl1和Acta2的非单调效应(图1 A)。
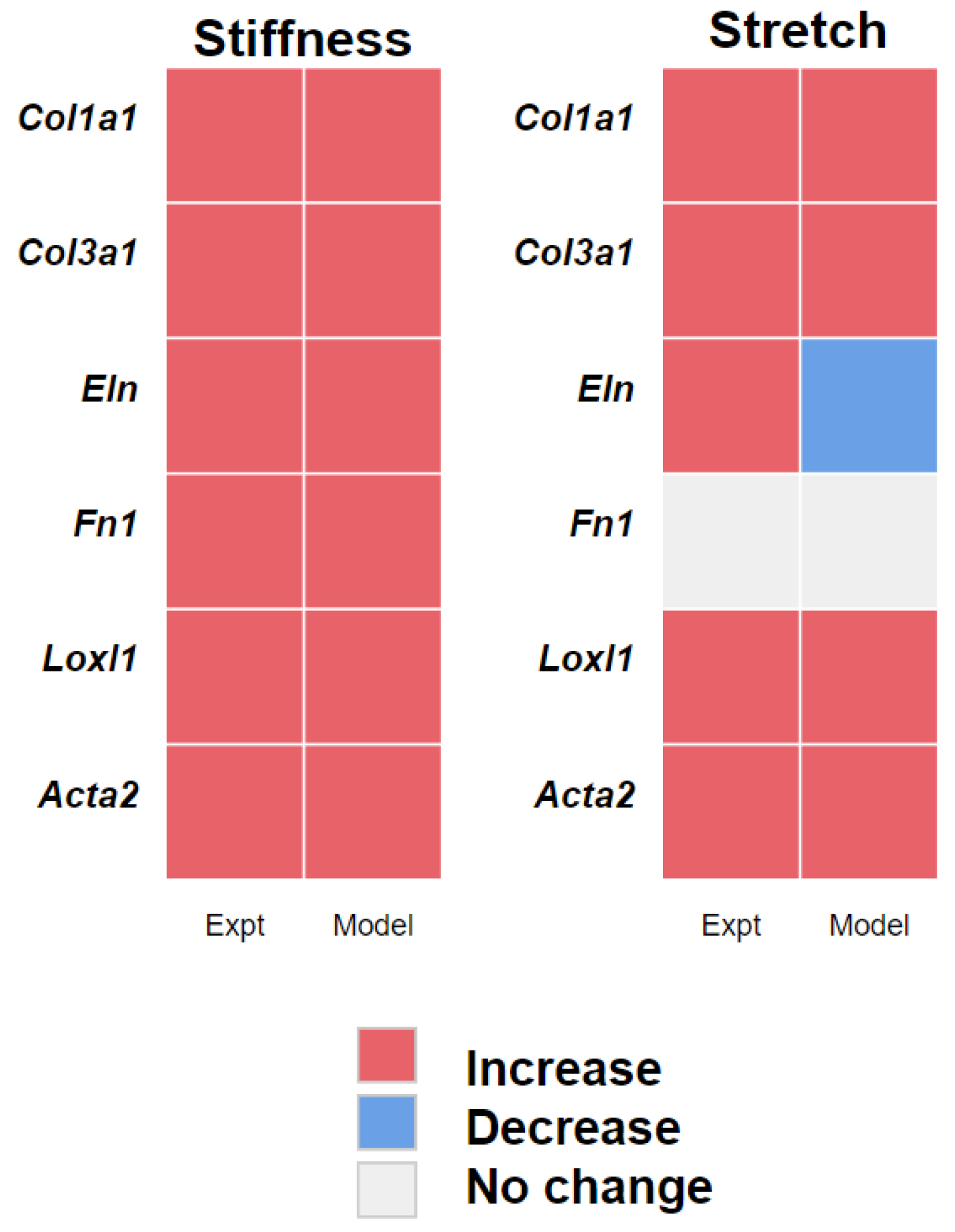
图3 由于拉伸和刚度引起的基因活性的实验观察(Expt)与模型预测(模型)的比较。
血管紧张素 II 受体抑制揭示了刚度和拉伸对纤连蛋白基因表达的相互作用
基于敏感性分析,实验模拟了模型中三个力学敏感节点(AT1、TGF-β、MST1/2)抑制剂存在时拉伸和刚度增加的影响。图4 显示了抑制AT1、TGF-β 和 MST1/2 对基质刚度从 0.5-3 kPa 增加以及拉伸引起的基因表达变化的影响。
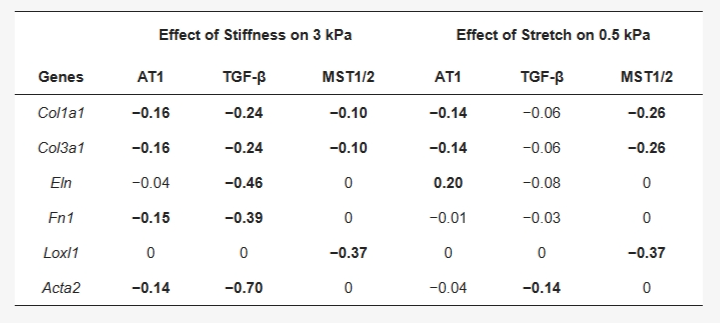
图4 由抑制血管紧张素II受体I型(AT1)、转化生长因子-β(TGF-β)和巨噬细胞刺激1或2(MST1/2)受体对刚度和拉伸的反应而引起的基因表达变化。
从模型模拟中可以看出,基质刚度增加对Loxl1表达的诱导是由MST1/2信号通路特异性调控的,而其他5个基因对刚度的反应均被阻断TGF-β受体显著抑制。AT1 受体抑制显著减弱了Col1a1、Col3a1、Fn1和Acta2的刚度依赖性诱导,但对Eln或Loxl1无显著影响,且抑制幅度明显小于阻断TGF-β受体时。在增加基质刚度的模型中阻断血管紧张素信号使胶原蛋白下调20%,阻断TGF-β信号使胶原蛋白下调30%,而阻断血管紧张素使Acta2下调17%,阻断TGF-β使其下调86%(图4)。
在施加拉伸刺激的同时阻断模型中的TGF-β信号抑制了Acta2的上调,并下调Eln。拉伸诱导的Col1a1和Col3a1通过抑制MST1/2和血管紧张素II信号而降低,而拉伸对Loxl1的调节仅通过抑制MST1/2受到影响。Fn1表达未因拉伸而显著改变,在所有三种抑制剂存在下均保持不变。这与它对基质刚度的响应形成鲜明对比,其中抑制AT1 和TGF-β受体具有显著作用(图4)。
由于该模型表明血管紧张素II信号在调节Fn1表达以响应刚度增加而不是拉伸时发挥重要作用(图4、图5 B),因此用1 M氯沙坦(一种AT1受体阻滞剂)处理培养的PAAFs。
与0.5 kPa相比,氯沙坦消除了3 kPa基质对纤连蛋白mRNA表达的诱导,并且在0.5 kPa基质上生长的PAAFs中的Fn1表达在24 h后仍然对拉伸无反应(图5 A)。当血管紧张素II信号被阻断时,拉伸显著上调了生长在较硬的3 kPa基质上的PAAFs Fn1的表达。
图5 A中各实验条件下Fn1表达对刚度、拉伸和AT1受体抑制增加的响应模型模拟如图5 B所示。该模型概括了对照条件和当基质刚度从0.5 kPa增加到3 kPa时纤连蛋白mRNA的增加,以及Fn1在3 kPa基质上对拉伸诱导的定性响应。该模型还正确预测了在拉伸和未拉伸条件下,氯沙坦对拉伸24小时后0.5 kPa基质上的Fn1 mRNA水平没有影响。然而,虽然在体外观察到氯沙坦通过增加未拉伸的PAAFs的刚度来抑制Fn1上调,但该模型无法重现这一观察结果。
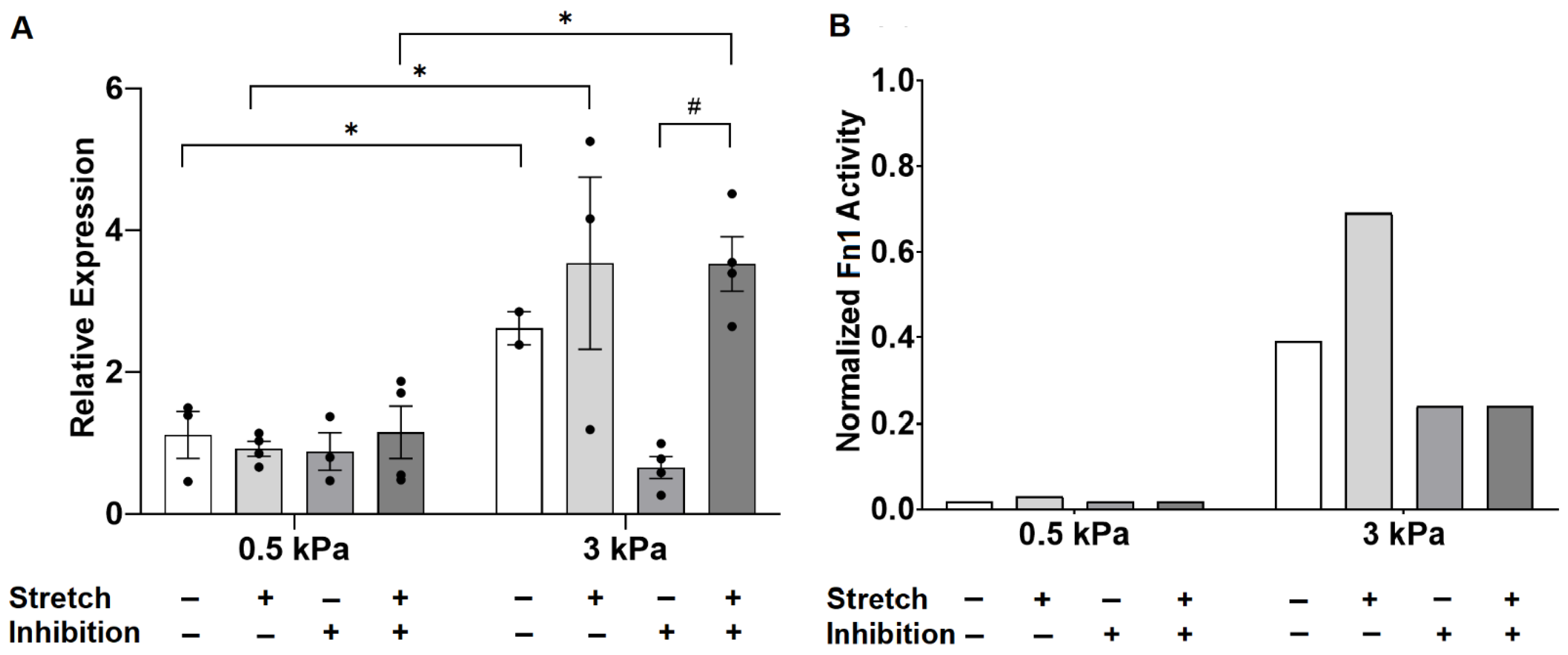
图5 使用和不使用AT1受体抑制剂氯沙坦时,纤维连接蛋白基因表达对基质刚度增加和10%等双轴拉伸的反应的实验观察。
总之,使用各种刚度的水凝胶底物在细胞拉伸装置中的体外实验表明,PAAFs对促纤维化基因的表达受细胞拉伸和细胞外基质刚度的差异调控。对于这里研究的六个基因,没有观察到拉伸和刚度之间的相互作用效应,然而,AT1受体阻断发现,当在坚硬而不是柔软的基质上生长时,通过拉伸,PAAFs中血管紧张素不依赖于Fn1表达的激活。响应改变的机械条件的PAAF促纤维化细胞信号的体外和计算机模型的新组合可能有助于识别血管外膜重塑的调节因子,这种调节因子是由体内PAH进展期间发生的拉伸和基质刚度的变化引起的。
参考文献:Wang A, Cao S, Stowe JC, Valdez-Jasso D. Substrate Stiffness and Stretch Regulate Profibrotic Mechanosignaling in Pulmonary Arterial Adventitial Fibroblasts. Cells. 2021 Apr 23;10(5):1000. doi: 10.3390/cells10051000. PMID: 33922850; PMCID: PMC8146344.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33922850/
小编旨在分享、学习、交流生物科学等域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。