弥漫性大B细胞淋巴瘤外泌体通过GP130/STAT3信号通路推动巨噬细胞向M2表型极化
研究表明,肿瘤来源的外泌体可以将免疫细胞驯化为促肿瘤表型并促进肿瘤进展,包括侵袭性血管生成和肿瘤增殖以及转移前微环境的形成。重要的是,免疫细胞向肿瘤微环境的募集和迁移受动态信号的调节,外泌体是这些相互作用的关键部分。
越来越多的证据表明,STAT3及其相关信号通路可能作为改变肿瘤免疫微环境的靶点,有利于肿瘤免疫治疗。STAT3在肿瘤和免疫细胞中被IL-6激活。相比之下,免疫细胞中STAT3的敲除可诱导参与先天性免疫和T细胞介导的适应性免疫的Th1介质,这反过来又导致免疫细胞的抗肿瘤活性增加,从而阻碍肿瘤进展。考虑STAT3在诱导肿瘤细胞和肿瘤相关免疫细胞免疫抑制方面的关键作用,更详细地了解STAT3介导的免疫抑制可能会改善癌症治疗。
肿瘤外泌体被巨噬细胞内化后,外泌体中哪些成分促进巨噬细胞极化为M2表型尚不清楚。更重要的是,弥漫性大B细胞淋巴瘤(DLBCL)衍生的外泌体的哪些成分使巨噬细胞适应为促肿瘤的M2样表型,其机制尚不清楚。GP130是IL-6家族的常见信号转导受体亚基,具有抗肿瘤、抗炎和抗伤害活性。在没有细胞因子配体的情况下,GP130突变体的持续激活导致JAK和 STAT3的持续激活,STAT3在炎症诱导的腺癌中的重要作用也在GP130在上皮中持续激活的转基因小鼠模型中得到证实。对GP130突变小鼠的研究表明,GP130和STAT3信号的激活导致炎症相关的胃肿瘤。这些人类和小鼠遗传研究表明,IL-6 / GP130 / JAK / STAT3信号轴的持续激活是诱发癌症的重要因素,这使其成为治疗或预防癌症进展的有吸引力的靶点。
因此,在苏州大学附属第二医院血液病科及医学生物技术研究所和合肥京东方医院核医学科研究团队的一项实验中,研究人员探讨了DLBCL衍生的外泌体促进THP-1来源的巨噬细胞极化为促肿瘤的M2样表型的机制。研究从不同角度证明,DLBCL来源的外泌体可以通过转移GP130来改变巨噬细胞的表型,有助于重建促瘤微环境。研究成果发表在 Chemico-Biological Interactions 期刊题为“Diffuse large B-cell lymphoma-derived exosomes push macrophage polarization toward M2 phenotype via GP130/STAT3 signaling pathway”。

首先,为了确定用外泌体处理的巨噬细胞对DLBCL细胞凋亡的影响,使用间接共培养系统,并通过Annexin V-FITC/PI 双染色法评估早期和晚期细胞凋亡。结果发现,含有不同DLBCL外泌体的M0巨噬细胞诱导用表阿霉素处理的DLBCL细胞凋亡减少。此外,在M2巨噬细胞和不同DLBCL亚型细胞的间接共培养中,依次用IL-4 / IL-13和DLBCL外泌体处理的巨噬细胞诱导用表阿霉素处理的淋巴瘤细胞凋亡减少。此外,在间接共培养条件下,含有淋巴瘤外泌体的不同阶段巨噬细胞对药物诱导的淋巴瘤细胞凋亡具有相同的作用。这些结果表明,含有肿瘤外泌体的巨噬细胞可能会促进耐药性。
然后,实验探讨了含有DLBCL衍生外泌体的巨噬细胞中的GP130 / STAT3信号传导。蛋白质印迹分析显示,GP130在不同DLBCL细胞的外泌体沉淀中大量表达(图1 A)。在不同的DLBCL细胞系(OCI-LY1、OCI-LY3、SU-DHL2、SU-DHL8)的亲代中也观察到类似的GP130表达(图1 B)。接着评估了不同DLBCL衍生的外泌体在不同分化阶段对巨噬细胞的影响,蛋白质印迹结果显示,在内化OCI-LY1或OCI-LY3来源的外泌体后,THP-1来源的M0巨噬细胞中的GP130和PSTAT3蛋白表达呈线性上调(图1 C、D)。在含有OCI-LY1或OCI-LY3衍生外泌体的M2巨噬细胞中也观察到GP130和PSTAT3的类似上调(图1 K、L)。
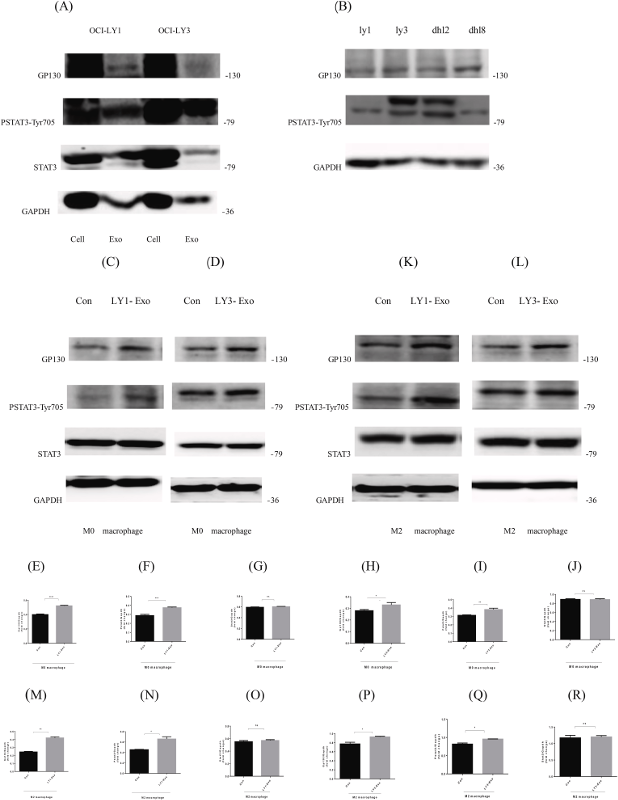 图1 GP130、PSTAT3和STAT3蛋白在DLBCL细胞和外泌体中的表达。
图1 GP130、PSTAT3和STAT3蛋白在DLBCL细胞和外泌体中的表达。
然后,为了评估巨噬细胞中GP130 / STAT3信号传导的激活,在含有OCI-LY1或OCI-LY3衍生外泌体的M0 / M2巨噬细胞中测定BCL2,SURVIVIN和BAX的表达,发现抗凋亡蛋白BCL2和SURVIVIN均上调,而凋亡蛋白BAX下调。数据表明,用DLBCL衍生的外泌体处理,巨噬细胞中STAT3信号下游靶蛋白的BCL2,SURVIVIN和BAX的表达发生了变化。结果表明,DLBCL外泌体部分影响巨噬细胞中STAT3信号的激活。这些结果表明,DLBCL衍生外泌体的内化激活了GP130/STAT3的活化,导致下游凋亡相关蛋白的失调,以及抗凋亡蛋白BCL2和SURVIVIN的上调和凋亡蛋白BAX的下调。
GP130抑制剂SC144结合GP130诱导GP130磷酸化和去糖基化,阻断STAT3磷酸化、核易位和进一步下游靶基因表达。因此,研究人员评估了SC144对含有DLBCL衍生外泌体的巨噬细胞细胞内STAT3信号激活的影响。蛋白质印迹结果显示,当用SC144处理时,GP130和PSTAT3在含有OCI-LY1/OCI-LY3衍生外泌体的M0巨噬细胞中下调(图2 A、B)。这表明,用SC144处理的DLBCL外泌体逆转了单独DLBCL外泌体在M0巨噬细胞中诱导的GP130和PSTAT3蛋白的上调。在含有用SC144处理的OCI-LY1 / OCI-LY3衍生外泌体的M2巨噬细胞中也观察到类似效应(图2 I、J)。
以上数据表明,受GP130抑制剂SC144干扰的DLBCL衍生外泌体可逆转M0/M2巨噬细胞中STAT3的活化,抑制剂干预组GP130和PSTAT3的表达下调,且两种蛋白的表达趋势一致。此外,DLBCL外泌体的GP130是诱导巨噬细胞在不同分化阶段激活STAT3信号的主要因素之一。
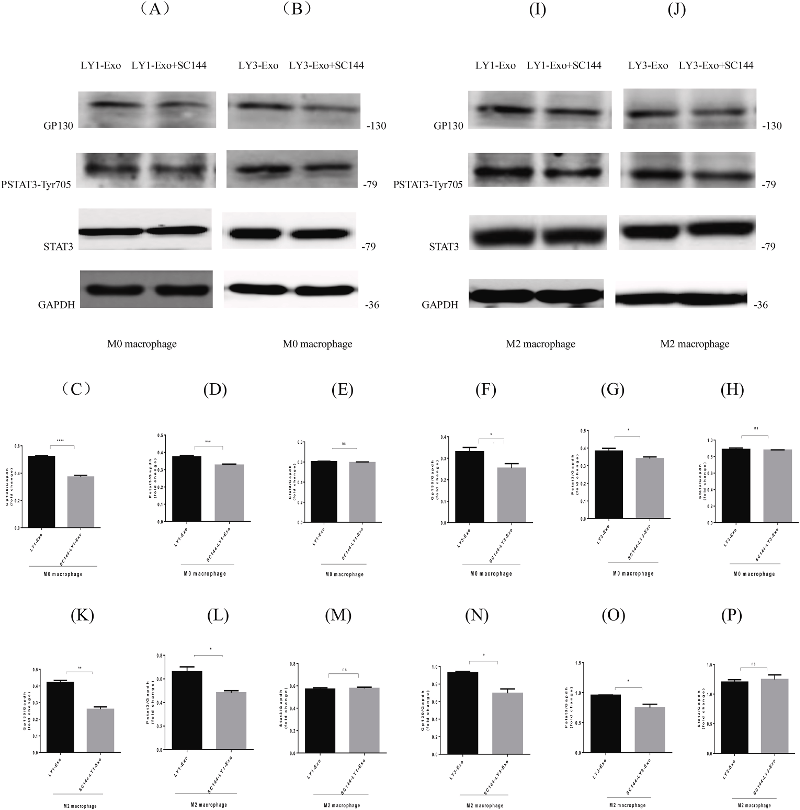 图2 SC144内化外泌体后,M0/M2巨噬细胞中GP130和PSTAT3的表达下调。
图2 SC144内化外泌体后,M0/M2巨噬细胞中GP130和PSTAT3的表达下调。
接着,评估了用SC144处理的DLBCL衍生外泌体是否可以逆转巨噬细胞中BCL2、SURVIVIN和BAX蛋白的上调表达,这是由DLBCL衍生的外泌体间接诱导的。结果显示用SC144处理的OCI-LY1/OCI-LY3衍生外泌体逆转了单独DLBCL细胞外泌体诱导的M0/M2巨噬细胞中BCL2、SURVIVIN和BAX的表达。这表明,STAT3信号传导的下游靶分子BCL2、SURVIVIN和BAX被逆转,这与DLBCL外泌体中GP130的抑制导致M0 / M2巨噬细胞中STAT3信号失活有关。
最后,实验进一步验证了用SC144预处理的DLBCL衍生外泌体可以逆转GP130激活STAT3信号所引起的巨噬细胞存活的变化,并继续使用SC144处理DLBCL衍生的外泌体,评估用其处理的巨噬细胞中M2表型相关标志物和细胞因子的表达。结果显示,与对照组相比,受SC144处理的不同亚型DLBCL衍生外泌体干扰的巨噬细胞中,M2表型相关标志物CD163、CD206和功能性细胞因子IL-10的基因表达下调(图3)。它逆转了由DLBCL衍生的外泌体诱导的M2表型相关标记基因CD163,CD206和IL-10的上调表达。验证了不同亚型DLBCL衍生的外泌体在基因水平上通过GP130促进M2样表型巨噬细胞的形成,并表明经SC144预处理的DLBCL衍生外泌体可以抑制外泌体单独诱导的M2样表型巨噬细胞的形成,进一步证明DLBCL衍生外泌体的GP130促进了M2样表型的形成。总之,它表明DLBCL衍生外泌体的GP130是促进巨噬细胞向更亲肿瘤的M2样表型极化的关键因素之一。
同时,用SC144预处理的外泌体也使巨噬细胞中IL-6的表达下调(图3),因为IL-6是GP130的配体,随着SC144的抑制,巨噬细胞中通过外泌体GP130激活STAT3信号诱导的IL-6上调表达的正反馈回路被破坏。总之,DLBCL衍生外泌体的GP130共同导致巨噬细胞STAT3信号的激活,促进巨噬细胞转化为促肿瘤M2样表型(图4)。
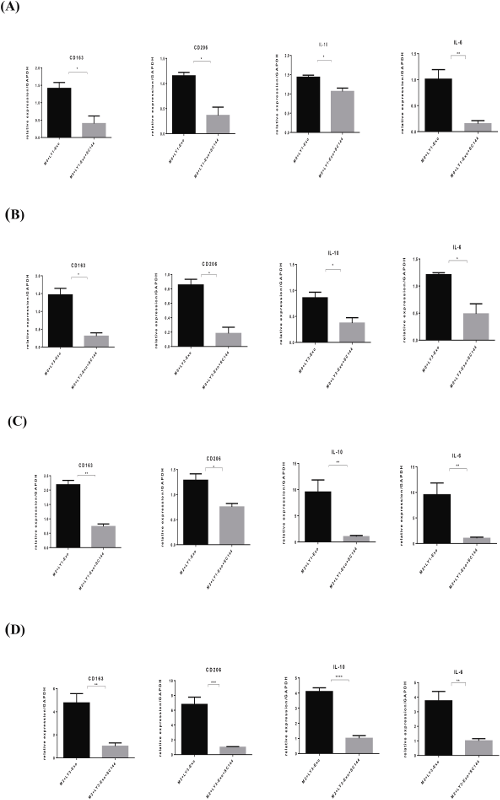 图3 用GP130抑制剂SC144预处理的外泌体可逆转DLBCL外泌体在M0/M2巨噬细胞中单独诱导的CD163、CD206、IL-10和IL-6的上调表达。
图3 用GP130抑制剂SC144预处理的外泌体可逆转DLBCL外泌体在M0/M2巨噬细胞中单独诱导的CD163、CD206、IL-10和IL-6的上调表达。
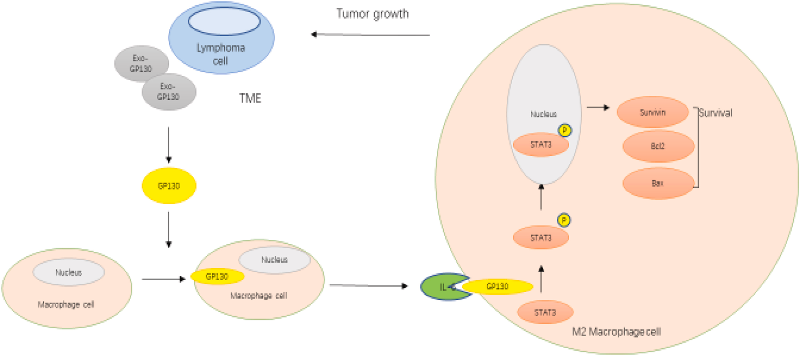 图4 说明DLBCL外泌体的GP 130介导TME巨噬细胞极化功能的示意图模型。DLBCL衍生外泌体的GP 130导致巨噬细胞STAT3信号的激活,促进巨噬细胞转化为促肿瘤M2表型。
图4 说明DLBCL外泌体的GP 130介导TME巨噬细胞极化功能的示意图模型。DLBCL衍生外泌体的GP 130导致巨噬细胞STAT3信号的激活,促进巨噬细胞转化为促肿瘤M2表型。
综上所述,DLBCL衍生的外泌体通过GP130激活巨噬细胞的STAT3信号,促进巨噬细胞向促肿瘤表型的极化。DLBCL衍生的外泌体通过将GP130转移到巨噬细胞上来重建肿瘤微环境,促进肿瘤进展。这表明癌症来源的外泌体在肿瘤和免疫细胞之间的物质交换中发挥重要作用。总之,这项研究提供了对外泌体蛋白质在癌症进展中的作用的见解,并进一步提高了我们对肿瘤来源的外泌体作为肿瘤微环境中重要介质的理解。以肿瘤微环境中的外泌体和巨噬细胞为治疗靶点,为DLBCL临床精准治疗提供了新的视角。
参考文献:Ling HY, Yang Z, Wang PJ, Sun Y, Ju SG, Li J, Fu JX. Diffuse large B-cell lymphoma-derived exosomes push macrophage polarization toward M2 phenotype via GP130/STAT3 signaling pathway. Chem Biol Interact. 2022 Jan 25;352:109779. doi: 10.1016/j.cbi.2021.109779. Epub 2021 Dec 17. PMID: 34922904.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34922904/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。