机械微环境在癌症发生和进展中的作用
癌症在促进肿瘤表型表观遗传重编程和修饰的复杂组织微环境中发展。此外,异常的微环境在肿瘤细胞的生长、侵袭和转移中发挥着重要作用。多项研究证实了肿瘤微环境的细胞和分子组成对癌症发生和发展的贡献。然而,物理刺激的影响仍有待完全阐明。
许多研究都集中在遗传基因和生化因素作为恶性肿瘤的原因。然而,物理因素通常被忽略。肿瘤细胞通常局限于特定的微环境,例如细胞外基质(ECM),而微环境的变化会影响肿瘤细胞的行为。因此,微环境的机械力学特性在癌症的发展、复发和转移中也起着关键作用。
肿瘤的生长和发育伴随着肿瘤微环境中机械因素的变化,例如肿瘤固体应力、基质硬度,以及由间质液压力的持续增加引起的间质液流动增强。力学在癌症进展中的关键作用已在过去十年中得到证实。在重庆大学生物工程学院生物流变科学与技术教育部重点实验室、日本名古屋大学机械工程系联合团队的一篇研究综述中,为了便于理解机械力如何影响癌症的发生和进展,讨论了机械力在通过机械转导促进癌细胞的代谢重编程和癌症干细胞(CSCs)的干性维持中的作用。文章名为《
Role of the mechanical microenvironment in cancer development and progression》。
肿瘤微环境
肿瘤微环境的组成成分
肿瘤微环境(TME)是 ECM 内的肿瘤细胞、基质细胞、免疫细胞、癌相关成纤维细胞和非细胞成分的复杂混合物。肿瘤中不适当的 TME 破坏会导致肿瘤细胞的恶性特征和癌症进展。
TME 中的机械力
最近的研究表明,除了来自微环境的生化信号外,物理信号可以显著改变细胞行为,例如增殖和转移潜能,超出了癌症干细胞的特征。肿瘤中的物理信号主要包括 3 个方面:基质刚度增加、固体应力升高、间质流体压力升高。这些力量不是在肿瘤内独立运作,而是在癌症发生和进展过程中相互作用。
ECM 重塑和硬化是实体瘤的特征,组织刚度已被用于检测各种人类癌症类型。肿瘤中的 ECM 硬化是由 ECM 蛋白和酶的过度活性导致基质重组引起的,这些蛋白和酶共价交联胶原纤维和其他ECM成分。此外,赖氨酰氧化酶在癌症中的过度表达归因于通过交联胶原纤维和其他 ECM 成分来增加组织硬度。
在肿瘤发生和肿瘤细胞快速增殖的过程中,生长诱导的固体应力会在肿瘤内积聚。实体瘤在压缩应力下生长,这对应于人类肿瘤 35–142 mm Hg 的机械负荷。固体应力包含在 ECM 和细胞元件中并由其传递,它可以通过压迫癌细胞直接影响癌细胞的生长,也通过压迫周围的血管和淋巴管间接影响癌细胞的生长。
流体应力包括微血管和间质流体压力,以及血液和淋巴流动对血管壁施加的剪切应力,以及间质流动对癌症、基质细胞和ECM施加的剪切应力。已经表明,即使是低水平的持续流体剪切应力也会显著和不同地影响卵巢癌不同发展阶段的黏附上皮细胞。如上所述,TME 内的间质流体压力可以指导细胞运动并促进肿瘤发生。
响应微环境力学的细胞内信号事件
来自细胞外环境的生物力学可以在称为机械转导的过程中被转导或转化为细胞内信号。这个复杂的过程涉及大量的信号分子和事件。细胞表面的机械敏感分子,例如粘附连接处的整合素和钙粘蛋白、受体酪氨酸激酶和离子通道,主要感知物理信号。
在被机械传感器感知后,生物力学信号可以通过 2 条途径向下游传递到局部粘着斑激酶(FAK)和细胞核(图1):生化机械转导和通过细胞骨架和核纤层的物理锚定直接转导到细胞核。这 2 种机械转导途径不是独立存在的,它们相互作用并影响癌细胞的特性,例如细胞增殖、粘附、细胞骨架重塑和迁移。
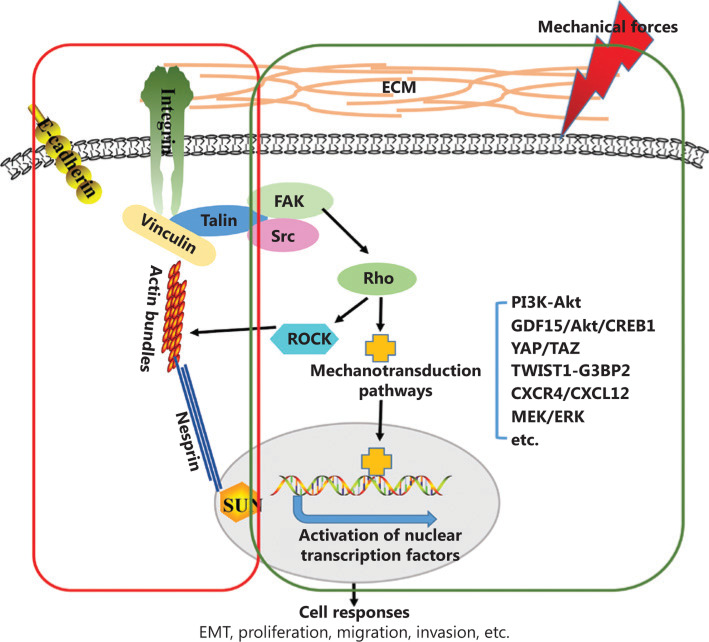
图1 从细胞外环境到癌细胞的生物力学力传递示意图。
TME 机械特性的变化通过 2 种不同的途径传递给癌细胞:细胞核-细胞骨架物理连接和生化信号传导。机械应力传递通过涉及整合素、F-肌动蛋白、nesprin 和 SUN 蛋白(红框)的细胞核-细胞骨架物理连接发生。此外,由生物力学力驱动的整合素聚集和粘着斑装配激活了生化信号通路,如 PI3K-Akt、GDF15/Akt/CREB1、YAP/TAZ、TWIST1-G3BP2、CXCR4/CXCL12 和 MEK/ERK(绿框)。
多种细胞内信号通路可以被机械信号激活,细胞内信号级联的激活影响癌细胞的生物学行为(表1)。研究表明,来自细胞外环境的生物力学力被传递到细胞内环境并转化为生化信号,从而调节癌细胞的行为。生物力学信号也可以从 ECM 传递到内部细胞骨架,并通过细胞核-细胞骨架物理连接转导到细胞核(图1)。

微环境力学影响癌症进展
机械力影响癌细胞行为
细胞与其 ECM 之间的物理相互作用已被证明可通过调节主要发育途径(如 Notch、Wnt 和 Hedgehog)影响与癌症进展相关的许多细胞行为。压缩应力在肿瘤生长过程中积累并使癌细胞侵袭,此外压缩应力抑制肿瘤球体的增殖。通过压缩应力实验模拟,肿瘤中的固体应力也被证明可以改变癌细胞的粘附和迁移。这些结果表明,TME 中的机械力促进了癌细胞的侵袭行为,包括增殖、迁移和球体发育。
微环境力学影响癌症干细胞
越来越多的证据表明,CSCs 具有许多对肿瘤发生、侵袭和复发至关重要的特征。CSCs 是肿瘤细胞的一个子集,在 TME 内也受到机械力的影响。深入研究CSCs的生物物理调控可能有助于揭示机械因素在促进癌症发生发展中的作用。
已发现机械因素在维持 CSCs 的干性中起重要作用。机械因素(如基质力学性能)不仅诱导癌细胞表现出恶性转化的特征,而且促进干细胞标志物的表达。最近,流体动力剪切应力已被证明可促进循环肿瘤细胞在血液循环中转化为不同的癌症干细胞样细胞。之前的研究也表明,软基质可以增加肝细胞癌(HCC)细胞的干性。机械功能受损的肿瘤组织通常伴有缺氧增加。因此,针对 CSC 生态位中的机械力可能会提供一种抑制 TME 驱动的 CSCs 激活的新方法。
TME 中共存的生化和生物力学信号共同驱动肿瘤进展。这些信号包括缺氧和 pH 梯度,可溶性信号和离子的梯度,ECM 的浓度、组织和刚度的改变所引起的物理力。细胞可以通过相同的细胞表面受体或信号通路调节对多种信号的定向反应。机械力、机械响应元件、生化信号和与细胞内信号通路的相互作用共同调节不同的细胞行为、细胞代谢和 CSC 特性的维持。然而,关于 TME 与肿瘤进展之间联系的许多问题仍有待解答。了解癌细胞如何在肿瘤的发生和进展中整合多个定向信号对于确定新的抗癌治疗靶点至关重要。
参考文献:Liu Q, Luo Q, Ju Y, Song G. Role of the mechanical microenvironment in cancer development and progression. Cancer Biol Med. 2020 May 15;17(2):282-292. doi: 10.20892/j.issn.2095-3941.2019.0437. PMID: 32587769; PMCID: PMC7309462.
原文链接:https://pubmed.ncbi.nlm.nih.gov/32587769/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。微信搜索公众号“Naturethink”,学习更多关于流体机械力学刺激细胞培养相关知识吧!