肿瘤细胞在非小细胞肺癌肿瘤微环境的新型体外共培养模型中调节巨噬细胞表型
鉴于化疗和肿瘤蛋白靶向治疗在非小细胞肺癌(NSCLC)中的局限性,免疫治疗方法已经取得了相当大的进展。然而,免疫检查点阻断(ICB)的长期获益仅发生在少数患者中,这表明迫切需要确定免疫抑制的其他机制,包括在肿瘤微环境(TME)中的机制,这可能会影响免疫治疗的疗效。巨噬细胞是TME中最丰富的免疫细胞之一,其活性通过多种机制与肿瘤进展有关。在生理和恶性发育过程中,巨噬细胞存在于“M1 型”促炎、免疫刺激表型和“M2 型”抗炎、血管生成、免疫抑制表型之间。
NSCLC TME中巨噬细胞的类型具有临床意义,NSCLC基质中M2型巨噬细胞的存在与预后不良有关。例如,抑制巨噬细胞衍生的精氨酸酶-1(Arginase-1,一种抑制T细胞增殖的精氨酸消耗酶)正在临床前研究和早期临床试验中。因此,理解和潜在地靶向产生免疫抑制巨噬细胞表型的潜在机制,特别是那些起源于单个NSCLC的巨噬细胞表型,将是很重要的。不同的NSCLC可能对TME中的巨噬细胞表型产生不同的影响。因此,我们需要一种可获得且可重复的临床前模型,该模型可以被操纵来解剖单个NSCLC细胞系如何产生特定的巨噬细胞表型。该模型可以作为研究调节巨噬细胞表型的治疗策略平台。
来自美国德克萨斯大学西南医学中心各处的研究人员曾旨在开发一种可重复且和生理相关的体外共培养模型,以研究参与巨噬细胞极化的肿瘤细胞和TME因子,并探讨可能的治疗策略。虽然存在类似的共培养研究,但没有一项研究询问了大量具有广谱分子亚型的患者来源的非小细胞肺癌细胞系对诱导巨噬细胞表型的影响。因此,该团队建立了一个多细胞共培养模型,包括72株不同患者来源的非小细胞肺癌细胞系、人类肿瘤相关成纤维细胞(CAFs)和小鼠骨髓来源的巨噬细胞(BMDMs),通过qRT-PCR研究诱导的巨噬细胞表型,并通过定量免疫组织化学在体内使用非小细胞肺癌异种移植物进行验证,并与癌症基因组图谱(TCGA)“匹配”患者肿瘤进行临床验证。研究成果发表在 Journal of Thoracic Oncology 期刊题为“Tumor Cells Modulate Macrophage Phenotype in a Novel In Vitro Co-Culture Model of the NSCLC Tumor Microenvironment”。

实验建立了小鼠 BMDMs、患者来源的 NSCLC 细胞和患者 CAFs 的多细胞共培养模型,以确定肿瘤细胞对巨噬细胞极化的影响。由于巨噬细胞来源于小鼠骨髓,实验利用一组小鼠特异性引物对巨噬细胞相关基因(Arginase-1、Il-1β、Socs3、iNos、Il-6、Ym-1)的表达进行qPCR分析,以评估巨噬细胞表型,此外研究了72 株不同的 NSCLC 细胞系和患者来源的 NSCLC CAF 细胞系。总体而言,与单独培养的巨噬细胞相比,大量患者来源的NSCLC 细胞系最常在共培养的小鼠巨噬细胞中诱导Arginase-1、Il-1β 和 Socs3 表达的增加。
为了表征给定基因的高表达与低表达,实验将高表达定义为与单独培养的巨噬细胞的基因表达相比变化≥75倍,将<75倍的变化定义为低表达。通过这种方法,Arginase-1(Arghi),通常与免疫抑制性 M2 样表型相关,是最常见的诱导表型,其次是Il-1β和Socs3。因此实验进一步研究了Arghi和Arglow 细胞群的临床病理和分子特征,以研究可能与共培养巨噬细胞中Arginase-1高表达相关的因素。
定量研究Arghi和Arglow细胞系巨噬细胞基因表达的差异,仅发现一个巨噬细胞基因 Il-6 在 Arghi 组的表达高于Arglow组。此外对一组15种NSCLC共培养物进行了批量RNAseq以比较qRT-PCR和RNAseq结果,发现在这个小组中巨噬细胞中 Arginase-1 的高表达与在相同的NSCLC 共培养的RNAseq样本中观察到的巨噬细胞表达模式显著相关。为了进一步研究小鼠巨噬细胞平台的发现是否可以在人巨噬细胞重现,使用了单核细胞分化的巨噬细胞与两种Arghi和Arglow细胞系共培养,结果发现 Arghi细胞系类似地将共培养的人巨噬细胞极化为M2样状态。因此,通过这种共培养模型,说明72 株不同的患者来源的 NSCLC 细胞系可重复地(对于每种细胞系模型)在共培养的小鼠巨噬细胞中诱导差异表达模式,最常见的是免疫抑制性 Arghi表型。
接下来,为了研究Arghi细胞系诱导的巨噬细胞表型是否在体内也能观察到,实验建立了Arghi细胞系(5株)和Arglow细胞系(6株)的裸鼠皮下异种移植,以测定宿主小鼠巨噬细胞的表型。结果发现,与Arglow系构建的NSCLC 异种移植物相比,Arghi系构建的NSCLC异种移植物的总巨噬细胞中位数密度和Arg1+ 巨噬细胞密度均显著高于Arglow系。因此,实验观察到来自Arghi NSCLC细胞系的异种移植肿瘤在肿瘤基质中具有显著更高的宿主小鼠Arg1+巨噬细胞密度,为体外研究结果提供了独立的体内证实。
为了研究临床样本中共培养系统中诱导巨噬细胞表型的外部有效性,实验研究了患者来源的 NSCLC 细胞系的 RNA 表达和突变数据,以“匹配”TCGA 数据库中具有相似mRNA表达和DNA突变谱的个体患者肿瘤标本。然后,我们利用来自TCGA和CIBERSORT的批量RNAseq表达数据量化这些临床标本TME 中的相对 M1 型和 M2 型巨噬细胞。这种方法能够将NSCLC共培养系统中诱导的巨噬细胞表型与临床样本中M2:M1巨噬细胞的比例相关联。
结果发现,来自任何一种NSCLC细胞系的共培养诱导的巨噬细胞表达模式与分子匹配的TCGA患者肿瘤中发现的巨噬细胞表型(来自CIBERSORT RNA表达分析)显著相关。与Arghi NSCLC细胞系匹配的TCGA样本的M2:M1比值显著高于与Arglow 细胞系匹配的TCGA样本。
这些发现表明,共培养系统中的患者来源的 NSCLC 细胞系诱导巨噬细胞表型,这些表型不仅在体内异种移植物中发现的相同 NSCLC 细胞系,而且与 TCGA 来源的患者肿瘤标本中发现的巨噬细胞表型相关,具有相似的 mRNA 和突变谱。这突出表明,实验中的模型有可能提供一个临床相关的平台,从中研究调节巨噬细胞表型的肿瘤细胞和TME因子。
最后,研究人员探讨了NSCLC模型中的临床病理学或人口统计学因素与诱导巨噬细胞表型之间是否存在任何相关性。迄今为止,尚未对这些因素在多种NSCLC肿瘤或患者来源的细胞系中对巨噬细胞表型的影响进行大规模研究。令人惊讶的是,没有一个标准的临床或分子变量与Arghi或Arglow NSCLC系显著相关。这些因素包括年龄、性别、种族、吸烟状况、临床分期、肿瘤基因型、总突变负荷、组织学亚型和上皮/间充质表型。
在观察特定的NSCLC肿瘤基因型时,发现在Arghi或Arglow队列中,最常见的基因突变是TP53、KRAS、TP53/KRAS、STK11和EGFR,与先前的研究相似。然后,实验进一步定量研究了肺癌细胞系中巨噬细胞Arginase-1 的表达与关键突变肿瘤基因(TP53、KRAS、STK11、KEAP1)的单独存在或相互组合,没有发现任何显著差异。
鉴于在体外共培养模型中,NSCLC肿瘤基因型与巨噬细胞Arginase-1表达之间没有显著相关性,实验还研究了这些发现是否在TCGA沉积的临床NSCLC样本中也观察到,结果同样发现M2:M1比值在性别、组织学亚型、年龄、总突变负荷或肿瘤基因型方面没有显著差异。因此,令人惊讶的是,实验发现与巨噬细胞共培养的NSCLC细胞系的临床病理学、人口统计学和分子学特征与巨噬细胞Arginase-1表达的高诱导或低诱导无关,这些因素也与TCGA数据集中的巨噬细胞表型无关。
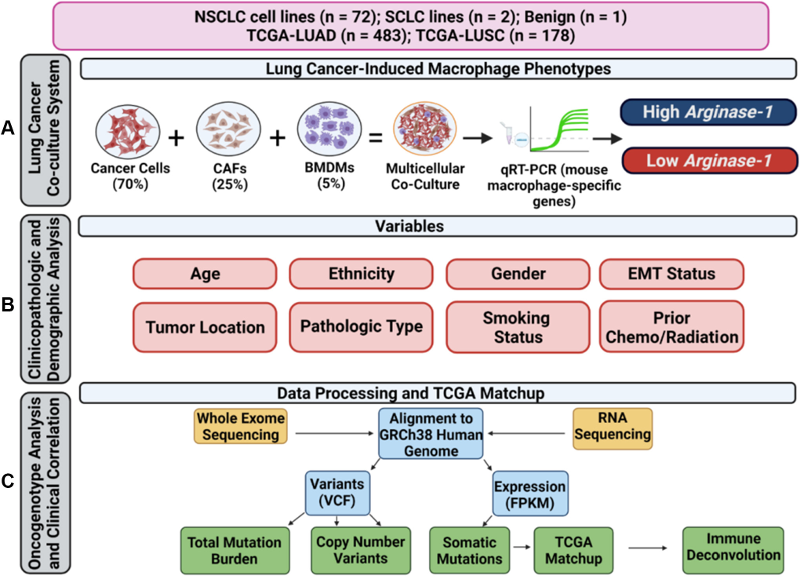
图1 非小细胞肺癌共培养系统诱导巨噬细胞表型研究综述。
(A)肺癌共培养系统测定。(B) 临床病理学和人口统计学分析。(C)癌基因型分析和临床相关性。
总之,该研究中的共培养系统是一个可获得的、集中的、可重复的NSCLC TME中巨噬细胞活性模型。研究发现,当与 CAFs 和小鼠巨噬细胞共培养时,大量患者来源的 NSCLC 细胞系最常诱导免疫抑制性 Arginase-1 的高表达,这与主要的临床、人口统计学和分子肿瘤基因型相关因素无关。这些表型在体内异种移植物中得到概括,并在TCGA沉积的肿瘤数据集中进一步得到临床验证。该共培养模型是早期研究NSCLC TME巨噬细胞生物学的有效工具,也是一个易于使用的系统,可用于研究遗传表达谱、临床病理相关性、计划体内研究的早期验证,以及筛选可能靶向巨噬细胞活性的新型化合物。因此,该共培养模型是一个强大的、生理一致的平台,从中可以研究肿瘤细胞和TME的特征以及可能影响巨噬细胞表型的新疗法。
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
参考文献:Park JV, Chandra R, Cai L, Ganguly D, Li H, Toombs JE, Girard L, Brekken RA, Minna JD. Tumor Cells Modulate Macrophage Phenotype in a Novel In Vitro Co-Culture Model of the NSCLC Tumor Microenvironment. J Thorac Oncol. 2022 Oct;17(10):1178-1191. doi: 10.1016/j.jtho.2022.06.011. Epub 2022 Jul 5. PMID: 35798240; PMCID: PMC9529910.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35798240/
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
Naturethink多细胞培养|共培养体系|共培养模型|共培养实验|动态细胞共培养|仿血流多细胞动态共培养系统