NRP1 通过增生性瘢痕中的 LATS1/YAP 转导机械应力抑制
增生性瘢痕(HS)是皮肤损伤后由于纤维组织过度增生而形成的一种皮损。压力衣治疗(Pressure Garment Therapy,PGT)是指通过压力衣对人体体表施加适当的压力,以预防或抑制皮肤瘢痕增生,防治肢体肿胀的治疗方法。PGT一直被用于降低HS,并取得了令人满意的效果,但其潜在机制尚不清楚。因此,阐明机械力的潜在生物学机制可能有助于确定 HS 治疗的可靠生物标志物。
神经纤毛蛋白1(NRP1)是一种细胞表面跨膜蛋白,在多种细胞类型中表达,并作为机械刺激的共同受体。研究表明,NRP1影响肌成纤维细胞和可溶性纤连蛋白之间的相互作用,促进整合素依赖性纤连蛋白原纤维组装、基质刚度和肿瘤生长。NRP1能否传递机械力的生物功能仍是未知数。YAP可感知机械力等物理特性。机械信号调控Hippo信号通路中YAP的上游蛋白,如大肿瘤抑制激酶1(LATS1),影响YAP的磷酸化和表达。最近的研究表明,使用YAP抑制剂阻断机械转导信号可促进继发性皮肤成分的伤口再生,这对疤痕治疗具有转化意义。YAP是机械微环境变化的重要传感器和伤口愈合的负调节因子,它可能参与PGT对HS的抑制。
在最近研究中,中山大学附属第一医院烧伤与创面修复外科以及精准医学研究院的研究团队发现了一种机械敏感的NRP1,它与体内和体外的机械力刺激呈正相关,实验通过控制 YAP 上游调节因子 LATS1 研究了 NRP1 在 YAP 表达中的调节作用。该研究展示了一种新的NRP1调控YAP的模型,该模型可转导机械生物学功能,这可能通过最佳和适合的压力作用增强PGT的治疗效果。研究结果为增生性疤痕的治疗提供了新的见解,相关内容发表在 Cell Death Discovery volume 期刊题为“NRP1 transduces mechanical stress inhibition via LATS1/YAP in hypertrophic scars”。

几种人类细胞类型对机械应力敏感,可以将机械信号转化为生化信号。因此,研究人员使用基因表达综合数据库(GEO)的数据筛选了在1 Hz频率(静波),压力为0.12和0.20下的机械压缩相关基因。首先,检索了包含软骨细胞对机械压缩反应数据的人类转录组阵列,NRP1被鉴定出来,然后在其他GEO数据集中验证了这一结果,即NRP1在不同细胞类型中受到机械应力的上调。数据表明,NRP1的表达与多种细胞类型的机械应力有关。
PGT通过减少血流量来抑制HS的形成,然而,这一过程知之甚少。因此,实验对四例接受 PGT 的 HS 组织进行了染色,并检测 NRP1。CD31染色显示NRP1选择性定位于HS内皮细胞中(图1 A)。这些结果表明,NRP1选择性地位于真皮内皮细胞膜上,机械应力促进了人HSs中NRP1的表达。
NRP1是细胞间作用力和剪切应力的感觉共受体。实验构建了一个 3D 水凝胶模型来研究机械力是否促进人真皮内皮细胞中 NRP1 的表达(图1 B)。水凝胶细胞的免疫荧光染色显示,NRP1 表达在 30 mmHg 压缩下显著增加(图1 C),与免疫印迹结果一致(图1 D)。
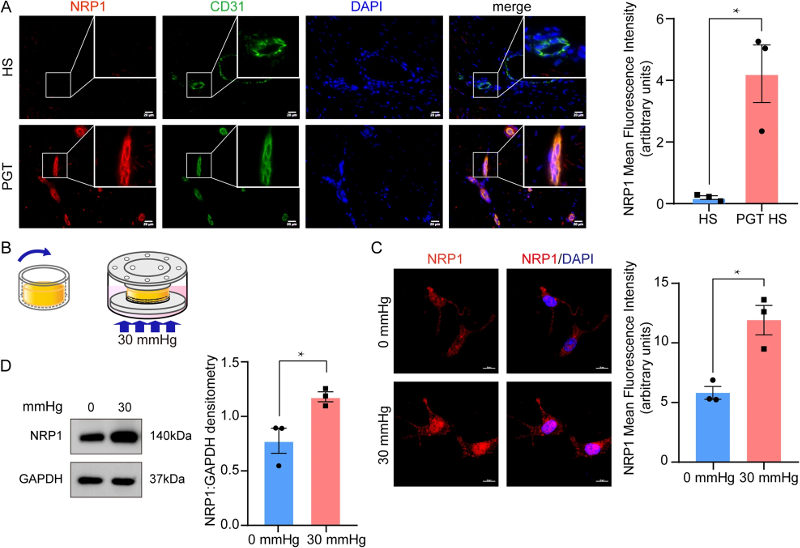
图1 机械处理可增加增生性瘢痕真皮内皮细胞中NRP1的表达。
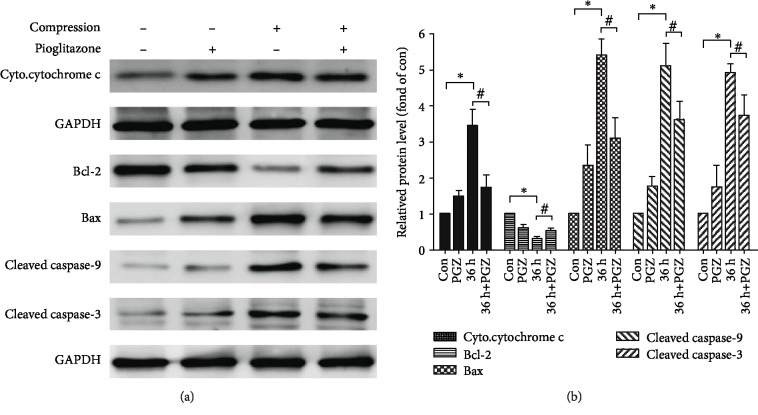
接下来,为了确定 NRP1 是否在人真皮微血管内皮细胞(HDMECs)中转导机械力,实验使用 NRP1-shRNA 敲低 HDMECs 中的 NRP1,并评估对照细胞和 NRP1 缺失细胞中的增殖和管形成水平。蛋白质印迹法确认NRP1敲低(图2 A)。Ki67免疫染色显示机械力抑制Ki67表达。NRP1缺失细胞表达较低水平的Ki67,并且在有或没有机械力的情况下Ki67表达没有差异(图2 B)。在管形成试验中也获得了类似的结果。机械应力抑制管形成试验的结果表明,NPR1缺失细胞的Nb连接和分支无显著差异(图2 C)。此外,NRP1敲低部分挽救了机械力诱导的抗血管生成作用。这些发现表明,NRP1有助于真皮内皮血管细胞的机械应激反应。
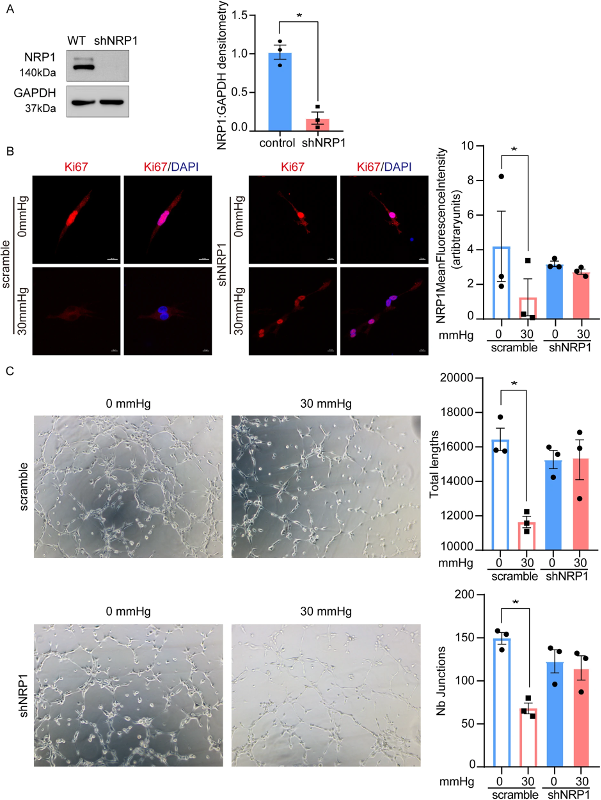
图2 抑制NRP1 损害了对体外机械诱导的抗血管生成的敏感性。
为了在体外验证NRP1与机械力之间的关系,研究人员使用HSs大鼠尾巴模型,将30只大鼠根据是否接受PGT随机分为两组。形态学和组织学分析显示,增生性瘢痕在第28天成功诱导,并通过PGT治疗减少。此外,免疫荧光分析表明,机械压缩显著促进了大鼠尾瘢痕真皮内皮细胞中NRP1的表达。这些发现表明,机械压缩诱导增生性瘢痕大鼠模型尾部NRP1的表达。
免疫染色结果显示,压缩处理显著降低了人增生性瘢痕和大鼠尾瘢痕组织中YAP的表达并促进了LATS1的表达(图3 A)。这些发现提示了一种新的压缩疗法治疗增生性瘢痕的机制。
由于实验观察到机械力显著抑制了YAP的表达,因此必须研究NRP1、YAP和LATS1之间的关系。免疫印迹分析显示,在30 mmHg压缩力下,LATS1、MST1、Salvador家族WW结构域蛋白1(SAV1)和Mps 1结合剂1(MOB1)表达同时增加,而YAP表达降低(图3 B)。
研究人员推测 NRP1 通过 LATS1 调控 YAP 抑制。与这一推测一致,NRP1 敲低消除了 LATS1 的刺激,从而促进了 YAP 表达。当受到增加的机械力时,NRP1的敲低阻止了LATS1的增加和YAP的降低。NRP1通过LATS1介导机械应力对YAP的干扰,但机械应力是YAP表达的另一个重要抑制剂(图3 C)。

图3 NRP1抑制降低了机械诱导的YAP表达、YAP与NRP1的结合以及YAP核质比。
最后,实验评估了与临床PGT的压力相匹配的持续24小时的不同机械压缩强度(0 mmHg和30 mmHg)对上游YAP的影响。免疫荧光染色结果显示,机械力增加了3D培养的HDMECs水凝胶中YAP的核定位。NRP1敲低抵消了高机械应力下增加的核/胞质YAP的比值(图3 D)。值得注意的是,YAP活性也以非依赖性Hippo通路的方式受到机械信号的影响。为了研究 NRP1 是否与 YAP 结合以及机械线索是否影响这种结合,实验使用免疫共沉淀来检测 NRP1 和 YAP 在 0 mmHg 和 30 mmHg 压缩下的结合。NRP1在无刺激的情况下与YAP共沉淀,然而,尽管NRP1表达增加,这种结合被机械压缩抑制(图3 E)。这些发现表明,机械压缩在抑制 YAP 和 NRP1 之间的结合后触发了 YAP 进入细胞核,然后释放的 YAP 易位到细胞核中。这些结果阐明了一种新的机械应力调控机制,其中NRP1与YAP结合并抑制YAP表达(图4)。
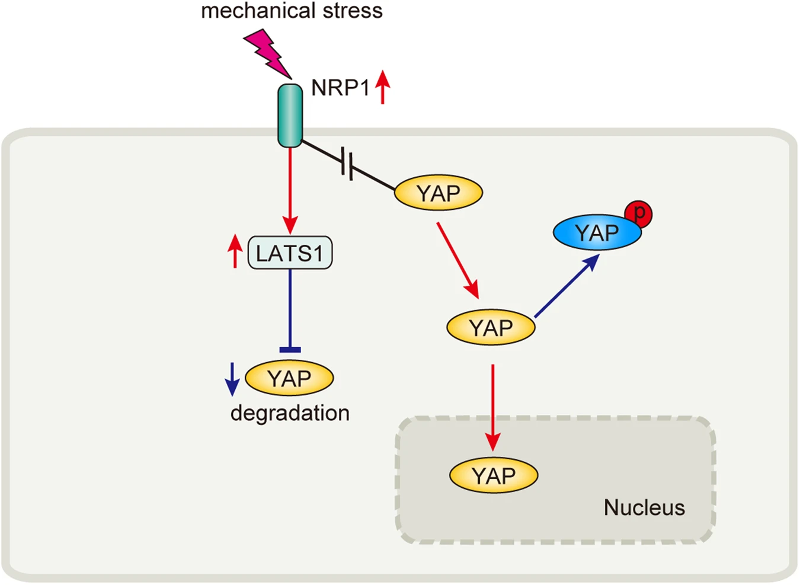
图4 NRP1 响应机械力刺激调控 YAP 。
NRP1 通过增加 LATS1 表达来抑制 YAP 表达,机械应力阻止 NRP1 和 YAP 的结合。
总之,该研究使用在线数据库、临床增生性瘢痕标本、压力培养的 HDMECs 模型和压力抑制的大鼠尾部瘢痕模型鉴定了一个与机械信号反应相关的基因-NRP1。机械敏感的跨膜 NRP1 通过 LATS1/YAP 信号转导轴介导机械应力的生物效应。NRP1介导机械应力对YAP的干扰,但机械应力是YAP表达的另一个重要抑制剂。该研究结果有助于提高PGT的疗效和HS患者的生活质量。
参考文献:Li M, Wang P, Li J, Zhou F, Huang S, Qi S, Shu B. NRP1 transduces mechanical stress inhibition via LATS1/YAP in hypertrophic scars. Cell Death Discov. 2023 Sep 13;9(1):341. doi: 10.1038/s41420-023-01635-3. PMID: 37704618; PMCID: PMC10499927.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37704618/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
Naturethink压力培养|压力刺激|压应力|机械压应力|细胞压力加载|细胞体外加力系统|细胞低压力、细胞正压力|仿生压力细胞培养仪