机械应力诱导的心血管疾病线粒体功能障碍:新机制和治疗靶点
线粒体(mitochondrion)是一种在大多数真核细胞中发现的细胞器,具有双膜结构,利用有氧呼吸产生三磷酸腺苷(ATP),这是细胞的主要能量来源。除了能量转换、线粒体脂肪酸合成、钙离子的摄取、储存和释放和细胞增殖调节外,线粒体还参与程序性细胞死亡、钙信号传导、细胞代谢调节、类固醇合成、激素信号和免疫信号传导。
在心血管系统中,线粒体内的氧化磷酸化是细胞内产生 ATP 的主要来源,而呼吸链产生的副产物维持氧化还原平衡。线粒体质量控制(MQC),包括抗氧化防御、蛋白质质量控制、线粒体 DNA 修复、线粒体动力学、线粒体自噬和线粒体生物合成,在整个心血管稳态中起着重要作用。然而,线粒体功能障碍常伴有代谢紊乱、过度氧化应激和离子过载,并参与各种心血管疾病(CVDs)的发生发展。
已经表明,机械应力与心血管稳态和功能障碍密切相关。心脏收缩和舒张引起的变形以及血流产生的血流动力学不断刺激细胞并调节下游机械信号。生理机械应力是心血管发育和体内稳态所必需的,而异常机械应力(包括高循环拉伸和扰动流)是致病性的。许多研究揭示了心血管系统中机械应力与线粒体之间的联系,表明线粒体作为机械敏感细胞器参与心血管病理与生理过程。
最近,上海交通大学生命科学技术学院及北京航空航天大学生物与医学工程学院的科研团队在一篇综述中探讨了心血管疾病中不同机械应力诱导线粒体功能障碍时线粒体在心血管生理学中的机制和信号通路,以寻找靶向线粒体功能障碍的潜在治疗方法。研究成果发表在 Biomedicine & Pharmacotherapy 期刊题为“Mechanical stress induced mitochondrial dysfunction in cardiovascular diseases: Novel mechanisms and therapeutic targets”。

心血管细胞中线粒体对机械应力的反应
机械应力代表调节细胞通路和组织功能的各种机械力,包括应力(由定向壁表面积归一化的力)、拉伸、压力、压缩和刚度。在心血管系统中,由于心脏的收缩和舒张,心脏组织和血管壁中的细胞(心血管细胞)暴露在机械环境中。机械力主要有三个方向:剪切应力、静水压力和循环拉伸。流动剪切应力分为不同的模式:正常剪切应力(层流剪切应力,LSS)、低剪切应力(LSS)和振荡剪切应力(OSS)。心血管系统中的主要机械应力如图1所示。在心血管细胞中,大量研究表明,生理机械应力(主要是剪切应力和循环拉伸)维持线粒体稳态,而病理性机械应力扰乱线粒体质量控制,损害电子转移链(ETC)中 ATP 的产生,并导致 Ca2+ 异常转运以及 ROS 积累触发的氧化应激。
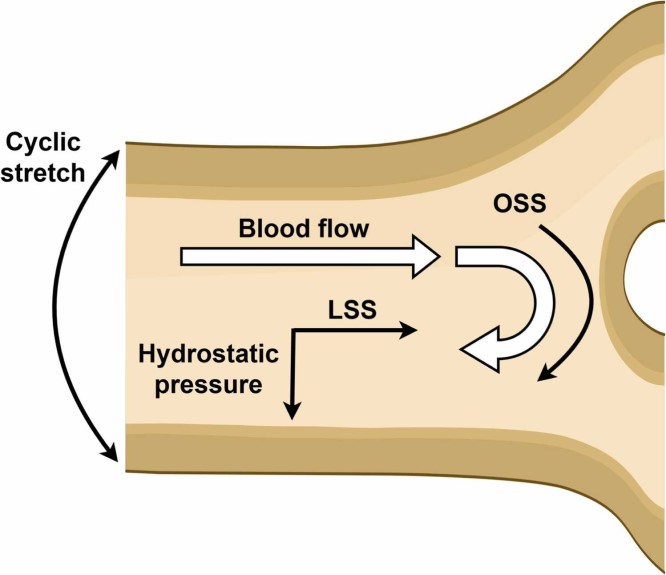
图1 心血管系统机械应力示意图。血管的直线、通畅的部位产生层流剪切应力(LSS),血流紊乱的血管分支和心脏瓣膜产生振荡剪切应力(OSS)。血液的重力产生垂直于血管壁和心脏的静水压力。心脏收缩和舒张引起的变形以及血流产生的血流动力学不断在心脏和血管中产生圆周循环拉伸。空心箭头表示血流方向,实心箭头表示机械应力方向。
在体外,10% 的环状单轴拉伸增加了心肌细胞的线粒体质量和 ATP 产生,没有 ROS 过度产生,也没有 Ca2+ 过载;15 dynes/cm2 的剪切应力通过降低血浆成员胆固醇来促进内皮线粒体 ATP 的产生,表明生理机械应力对于维持线粒体能量供应是必需的。此外,线粒体功能的机械应力调控依赖于线粒体形态和结构的适应。兔心脏的挛缩、静息和拉伸实验显示,与静息相比,拉伸诱导的线粒体形状更细长。线粒体网络被认为可以增强线粒体通讯,更快地传输电子,并实现细胞范围的机械信号传导。与静态(0%)、异常低(6%)或病理性高(50%)幅度拉伸相比,生理性(25%)拉伸维持了线粒体网络结构,使 ATP 最大化,mtROS 最小化。同样,在产生单向血流的胸降主动脉中观察到生理性线粒体,但在血流紊乱的分叉部位则没有。
线粒体对细胞外机械应力的反应至少部分取决于机械敏感离子通道。Piezo1 与剪切应力机械转导和 Ca2+ 内流细胞相关。LSS 至少部分通过 Piezo1 相关通路激活 ECs 中的 ERK5/Klf2 轴,并可能通过线粒体自噬来实现。因此,Piezo1 可能是与线粒体机械反应相关的重要受体,调节抗炎因子 Klf2 和动脉病变的形成。此外,Piezo1 通道活化通过促进血管 ECs 中的线粒体呼吸和糖酵解来诱导 ATP 的产生,表明 Piezo1 通道在内皮 ATP 产生中具有新的作用。
总体而言,心血管细胞持续暴露于机械微环境,具有适应机械应力的特定结构和机制,而线粒体在这种适应中起着至关重要的作用。值得注意的是,线粒体是否能直接感知机械刺激以及这一过程中的分子机制还有待进一步阐明。
机械应力诱导心血管疾病中的线粒体功能障碍
1. 压力超负荷诱发的心力衰竭
心力衰竭(HF)是一种由心脏泵血功能失常引起的慢性疾病,其特征是多方面心脏功能不全,如心脏收缩和/或舒张功能受损、射血分数降低、心室充盈。心脏充盈压长期升高是心衰发生的关键原因,因为机械应力超负荷会破坏细胞内和细胞间稳态,其中线粒体功能障碍起重要作用。值得注意的是,压力超负荷期间的机械力同时涉及心肌拉伸和应力的影响,共同诱发机械力超载。
机械应力超负荷诱导 HF 中线粒体代谢异常。对小鼠和大鼠的血管收缩模型的研究证明,心衰与脂肪酸氧化减少、糖酵解增加以及线粒体呼吸受损有关。线粒体功能障碍归因于机械应力诱导的线粒体微观结构异常和多种酶的缺乏,例如酰基辅酶A(CoA),一种脂肪酸代谢调节剂,在小鼠和人类衰竭的心脏中减少。在小鼠中,酰基辅酶A合成酶1(ACSL1)的过表达可防止长链脂肪酸氧化障碍并增加线粒体能量电位(PCr:ATP),从而减轻心肌肥大并改善心脏功能。使用左心室辅助装置进行机械卸载可恢复心衰患者的 CoA 表达,类似于小鼠中 ACSL1 的过表达。如上所述,线粒体呼吸受损会诱导过多的 mtROS 产生,从而导致心脏损伤。烟酰胺核糖(NR)通过 NAD+/Sirtuin3/MnSOD 轴减少 mtROS 的产生和 NLRP3 炎症小体的活化,从而防止应力负荷诱导的心脏功能障碍。
机械敏感蛋白也参与 HF 中病理性机械应力向线粒体的转导。Piezo1 在心脏衰竭患者中表达增加。心肌梗死后,异常机械应力激活 Piezo1 并诱导细胞内 Ca2+ 过载,进一步激活钙调蛋白激酶II(CaMKII),导致 Ca2+ 渗漏和心律失常。因此,超负荷机械应力诱导的 Piezo1 过度激活是 HF 期间线粒体信号传导的起始。
最近,研究发现,参与 Hippo 通路的机械敏感转录共激活因子Yes相关蛋白1(Yap1),由于机械应力超负荷而损害线粒体生物合成,进而诱导心肌细胞肥大。与 TEAD1基序结合(TEAD1-Yap1)的 Yap1 活化会抑制 Drp1 和 Mfn1 的表达,导致更多的丝状和分叉状的异常线粒体形态以及呼吸功能下降。
此外,机械应力诱导的 HF 线粒体功能障碍也与神经系统有关。单胺氧化酶(MAO)-B是一种线粒体黄素蛋白酶,主要分布于中枢,负责代谢脑中多巴胺。MAO 的激活增强了 mtROS 的形成并降低了线粒体膜电位,表明了机械应力下 HF 的新发病机制。
压力超负荷诱导 HF 中线粒体功能障碍的分子机制如图2左侧所示。压力超负荷引起的代谢异常会损害线粒体呼吸并诱发氧化应激,其中机械敏感受体相关通路在这一过程中起重要作用。重要的是,促进新陈代谢和增强线粒体功能有助于心脏抵抗机械应力相关病理。改善线粒体功能有利于心肌细胞对代谢物的利用,揭示了从力学和代谢角度治疗心力衰竭的前景。
2. 动脉粥样硬化剪切应力诱导的内皮功能障碍
单层血管 ECs 与血流直接接触,并不断感知机械刺激。ECs 是抑制白细胞过度浸润的重要屏障,其损伤通常是动脉粥样硬化的开始。与动脉直线部分的 LSS 相比,动脉粥样硬化斑块往往发生在具有 OSS 的动脉弯曲和分支处,这表明剪切应力对内皮稳态至关重要。
已知 LSS 有益于内皮屏障功能和体内平衡,其中线粒体在这一过程中起重要作用。它是线粒体动力学、生物合成、呼吸和抗氧化功能所必需的,并维持内皮 Ca2+ 体内平衡,促进抗炎作用。相反,扰动流或 OSS 往往是有害的。牛主动脉内皮细胞的体外研究表明,OSS 通过 NADPH 氧化酶和 JNK 活化增强 mtROS 的产生。OSS 会损害线粒体呼吸并诱导氧化应激,从而阻断自噬通量,同时增加 LC3-II/LC3-I 比值和 p62 水平,导致 mtDNA 损伤。最近,有研究阐明,OSS 和促炎刺激通过改变 KLF2 表达来抑制关键的线粒体抗氧化蛋白 UCP2,而提高 UCP2 水平可能具有抗动脉粥样硬化的治疗潜力。OSS 诱导的动脉粥样硬化中线粒体功能障碍的分子机制如图2右侧所示。
因此,ECs 中的线粒体在不同剪切应力下具有不同的响应和信号转导。阐明不同剪切应力下 ECs 线粒体的分子机制将有助于找到合适的潜在治疗靶点。此外,了解其他细胞类型(如血管平滑肌细胞、巨噬细胞和泡沫细胞)在剪切应力诱导的动脉粥样硬化期间线粒体功能中的变化十分重要。它将为推动疾病治疗的潜在机制提供有价值的见解,并可能为缓解动脉粥样硬化相关并发症提供潜在的治疗靶点。
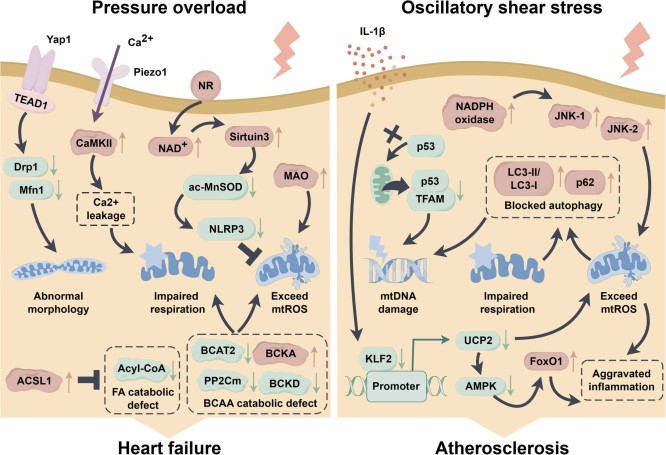
图2 压力超负荷诱导心力衰竭(HF)和振荡剪切应力诱导动脉粥样硬化中线粒体功能障碍的分子机制。红色细箭头表示增加或激活,而绿色细箭头表示减少或失活。
3. 线粒体相关VSMC表型转化的力学视角
VSMC 表型的可塑性已被广泛探讨。VSMCs 在导致多种血管疾病的病理因素刺激下可由收缩表型转化为合成巨噬细胞样表型。重要的是,线粒体通过代谢重编程和 Ca2+ 稳态调节 VSMC 表型。线粒体网络与细胞骨架相互作用以响应刚度和血流动力学,表明线粒体在 VSCM 表型转变中的作用受机械应力的调节。然而,机械应力在不同血管疾病中如何通过线粒体调控 VSMC 表型的具体机制有待进一步探索。
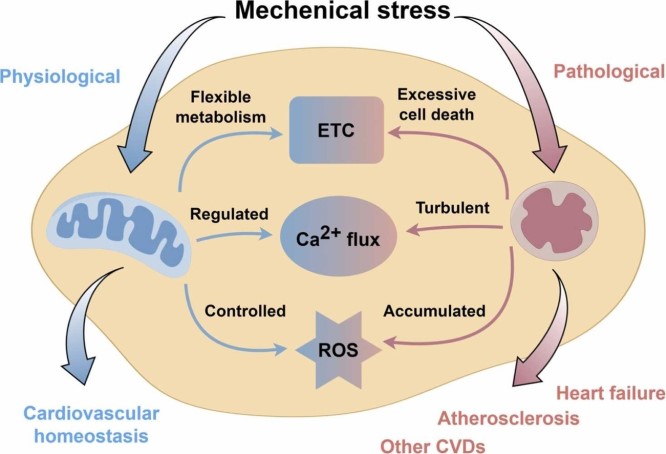
图3 图形概要
心血管疾病在生理性机械应力下的线粒体功能和病理性机械应力下的线粒体功能障碍。
综上所述,机械应力引起的线粒体功能障碍是解释心血管疾病机制的至关重要且不可否认的因素,可作为治疗心血管疾病的重要潜在靶点。目前许多研究都将线粒体功能障碍作为心血管功能障碍的指标,但线粒体如何诱导心血管细胞的病理过程,如异常细胞形态、细胞死亡等需要进一步研究。此外,对机械转导诱导的线粒体相关信号通路的不完全理解阻碍了寻找治疗 CVDs 的新靶点。因此,需要更多的证据来证明线粒体是否可以直接感知机械刺激。除了心衰和动脉粥样硬化外,亟需更多的研究来探索机械应力诱导的线粒体功能变化在其他心血管疾病(如心律失常、动脉瘤、高血压和内皮损伤)中的作用和机制,以及阐明心血管系统中不同应力的相互作用及其分子机制。
参考文献:Ren H, Hu W, Jiang T, Yao Q, Qi Y, Huang K. Mechanical stress induced mitochondrial dysfunction in cardiovascular diseases: Novel mechanisms and therapeutic targets. Biomed Pharmacother. 2024 May;174:116545. doi: 10.1016/j.biopha.2024.116545. Epub 2024 Apr 10. PMID: 38603884.
原文链接:https://pubmed.ncbi.nlm.nih.gov/38603884/
图片来源:所有图片均来源于参考文献
本文旨在分享、交流生物领域研究进展,关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生压力细胞培养仪NK-P40
点击了解:仿血流剪切应力培养系统NK110-STD



