EVA1A(Eva-1 同源物 A)通过调控自噬在扰动流下促进内皮细胞凋亡和炎症激活
动脉粥样硬化是一种慢性炎症性动脉疾病,血流施加在内皮细胞上的血流动力学壁剪切应力(WSS)决定了动脉粥样硬化病变的空间分布。低 WSS 量级的反向扰动流(DF)促进内皮细胞(EC)炎症和凋亡,推动动脉粥样硬化发展,而单向且高 WSS 量级的 un-DF 具有动脉粥样硬化保护作用。
EVA1A(Eva-1 同源物 A,也称为 FAM176A)最初被鉴定为一种溶酶体和内质网相关蛋白,与自噬体共定位并促进细胞凋亡和自噬。研究已表明,EVA1A 在心血管系统中发挥作用。小鼠心肌细胞特异性敲除 EVA1A 通过损害自噬导致快速心力衰竭。EVA1A 也可能参与斑块稳定性的调节,因为与无症状的人颈动脉斑块相比,在有症状的人类颈动脉斑块中发现 EVA1A mRNA 表达增加。然而,包括自噬调节作用在内的潜在机制尚不完全清楚。
因此,英国谢菲尔德大学感染、免疫和心血管疾病系及伦敦帝国理工学院国家心肺研究所的科学家在一项研究中尝试探索了 EVA1A 在 WSS 调控的内皮功能障碍和血流暴露的 ECs 自噬调控中的作用。研究成果发表在 Arteriosclerosis, Thrombosis, and Vascular Biology 期刊题为“EVA1A (Eva-1 Homolog A) Promotes Endothelial Apoptosis and Inflammatory Activation Under Disturbed Flow Via Regulation of Autophagy”。

首先,在健康猪和小鼠的主动脉中研究血流对 EVA1A 表达的影响(图1 A-C)。与外曲率和降主动脉(未受扰动流影响,UF 区域)相比,EVA1A 在主动脉弓内曲率(DF 区域)的 mRNA 和蛋白表达增加(图1 B、C)。EVA1A 蛋白定位主要在细胞膜和细胞质中。然后,将EVA1A 暴露于流动的人脐静脉内皮细胞(HUVECs)和人主动脉内皮细胞(HAECs),利用体外剪切力模型产生DF。DF 增加了 EVA1A mRNA 和蛋白质表达水平(图1 D、E),且 EVA1A 定位与在小鼠主动脉中观察到的相似。这些数据表明,EVA1A 的表达在体内和体外均受 WSS 调节,并且受促动脉粥样硬化的 DF 诱导。
为了研究生理血流条件下 EVA1A 在人 EC 中的作用,使用 siRNA 在 HUVECs 中敲低 EVA1A,评估其对细胞凋亡的影响。与暴露于 UF 的 ECs相比,暴露于 DF 的 ECs 凋亡水平显著增加。EVA1A 缺失使 DF 条件下的 EC 凋亡水平降低到与 UF 条件相当的水平,表明 EVA1A 在 DF 下促进 EC 细胞凋亡。
除了细胞凋亡外,内皮细胞增殖失调也可能导致内皮细胞周转增加。因此,通过分析暴露于流动或静态条件下的 EVA1A 缺失型 ECs 中增殖标志物 PCNA 的表达来检测 EVA1A 是否调节 EC 增殖,发现在任何研究条件下,与对照细胞相比,敲低EVA1A 未观察到 PCNA+ 增殖细胞比例的显著差异。
由于细胞凋亡与血管渗漏有关,因此评估了 EVA1A 敲低对 EC 通透性的影响。暴露于 DF 72 小时后,与对照细胞相比,EVA1A 缺失的 ECs Rd-白蛋白的渗透性较低。同时,与对照细胞相比,EVA1A 基因敲低对静态条件下细胞的通透性无显著影响。
此外,还测量了 DF 诱导的几种炎性细胞因子和粘附分子在 EVA1A 缺失型 ECs 中的表达,发现在 DF 条件下,敲低 EVA1A 导致 SELE、VCAM1 和 IL-8 的 mRNA 水平显著降低,而 ICAM1 表达降低的趋势不显著。然而,在 UF 或静态条件下,EVA1A 缺失不会导致炎症标志物表达的变化,表明 EVA1A 对炎症激活的影响取决于血流条件。同时,还发现在 TNF 刺激的 ECs 中敲低 EVA1A 导致 DF 下单核细胞与内皮细胞粘附降低的趋势,但没有达到统计学意义,表明 EVA1A 可能引发了 ECs 对单核细胞的粘附。
这些数据表明,EVA1A 介导 DF 对 EC 细胞凋亡和炎症激活的影响,导致 EC 通透性增加。
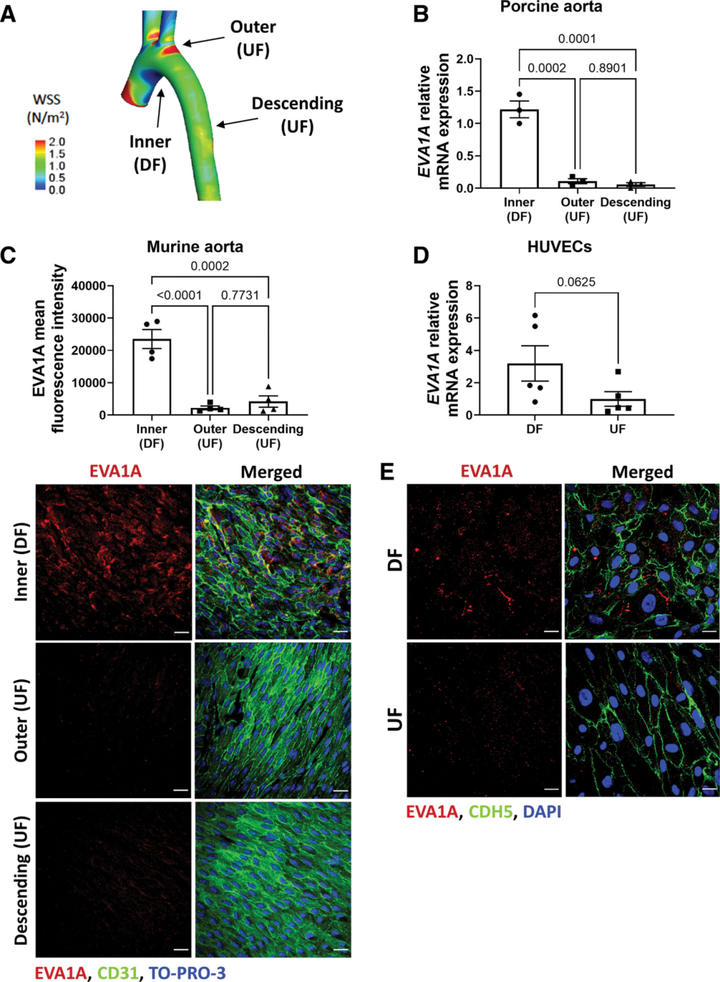
图1 EVA1A 是由猪、小鼠和人内皮细胞(ECs)的促粥样硬化剪切应力诱导的。
接下来,为了测试 EVA1A 在生理流动条件下是否在 ECs 的自噬调节中发挥作用,使用自噬溶酶体抑制剂巴弗洛霉素(Bafilomycin)测量了 EVA1A 沉默的 ECs 中的自噬通量。LC3-II 和 P62 是自噬的标志性蛋白。在没有巴弗洛霉素的情况下,暴露于 DF 后,与对照组相比,EVA1A 缺失细胞中 LC3-II 表达有增加的趋势,但并不显著。然而,与对照 ECs 相比,使用巴弗洛霉素阻断自噬通量导致 EVA1A -沉默的细胞中 LC3-II和 p62蛋白水平显著富集,表明 EVA1A 缺失的细胞中自噬通量增加。相比之下,在 UF 条件下,在存在或不存在巴弗洛霉素的情况下,EVA1A 敲低细胞和对照之间的 LC3-II 和 p62 水平没有差异,表明 EVA1A 在 UF 条件下不调节自噬。
为了确定 EVA1A 是否通过调节自噬促进 DF 下的 EC 凋亡,评估了阻断自噬通量对 EVA1A-沉默细胞中细胞凋亡的影响(图2 A、B)。EVA1A 沉默的对照细胞(DMSO处理)中 EC 细胞凋亡降低,这与 EVA1A 的促凋亡功能一致。然而,巴弗洛霉素处理恢复了 EVA1A 缺失型细胞的细胞凋亡,使其达到与对照细胞相当的水平(图2 A、B)。同时,用巴弗洛霉素处理 DF 暴露的对照细胞不会导致 EC 细胞凋亡的显著增加。这些数据表明,EVA1A 降低暴露于致动脉粥样硬化 DF 的 ECs 中的自噬通量,导致 EC 功能障碍。
致动脉粥样硬化 DF 的特征是低幅度 WSS 和 WSS 方向的变化。为了确定 DF 的这 2 种作用哪一种负责 ECs 中的 EVA1A 诱导,使用了平行平板流动系统(图2 C)。有趣的是,与层流高WSS(13 dynes/cm2)相比,当 ECs 暴露于层流低 WSS(4 dynes/cm2)时未诱导 EVA1A mRNA 表达,但当暴露于低振荡 WSS(LOSS,4 dynes/cm2,1 Hz)时其显著上调。这表明,当 ECs 暴露于 DF 条件下时,是流向的扰动,而不是 WSS 幅度,导致 EVA1A 上调。
TWIST1(人类直系同源物为TWIST1)蛋白是一种进化上高度保守的碱性螺旋-环-螺旋转录因子,可被 DF 激活并促进内皮功能障碍和动脉粥样硬化,这使其成为 DF 敏感调节 EVA1A 的有力候选者。通过 siRNA 敲低 ECs 中的 TWIST1 来测试 TWIST1 是否调控 EVA1A mRNA 表达(图2 C),结果发现,DF 条件下TWIST1 的缺失显著降低 EVA1A mRNA 表达,表明 EVA1A 是 TWIST1 的下游靶点(图2 D)。
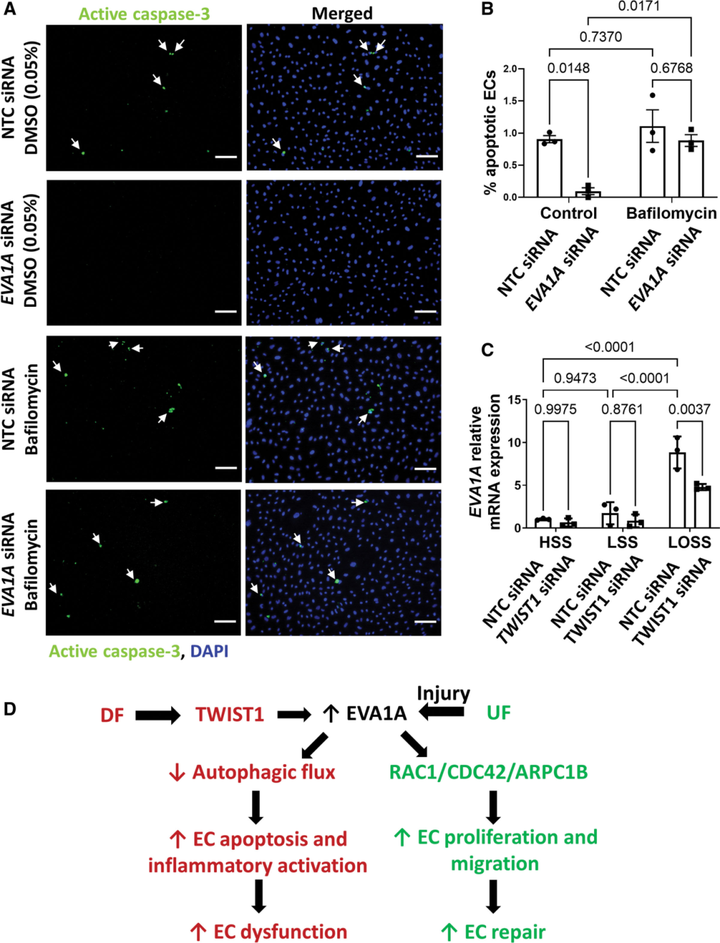
图2 EVA1A 通过调节自噬促进内皮细胞凋亡。
为了测试 EVA1A 在体内 ECs 中的作用,建立了血流调控 EC 细胞凋亡的斑马鱼模型。在斑马鱼基因组中鉴定出两个 EVA1A 直系同源物 Eva1a-1 和 Eva1a-2,发现 Eva1a-1 在内皮 GFP+ 细胞中不表达,而 Eva1a-2 存在于内皮型 GFP+ 和非内皮型 GFP+ 细胞中,且在后者中表达更高。因此,重点关注于 Eva1a-2 直系同源物在斑马鱼内皮中的作用。
然后,注射 Silent Heart(sih)吗啡啉(MO,可特异性敲低 Eva1a-2)来阻止血液循环(图3)。血流停止显著增强了 EC 细胞凋亡(图3)。敲低 Eva1a 对在受精后 30 小时血流正常的胚胎中 EC 凋亡的基础水平没有显著影响,而使血流停止诱导的 EC 凋亡降低了15%(图3 A、B)。同时,在受精后 30 小时观察到的每组 EC 总数没有显著差异,表明在 Eva1a 缺失的胚胎中观察到的细胞凋亡减少不是数量改变的结果。因此,EVA1A 促进斑马鱼胚胎在体内血流停止(而非无血流)情况下 EC 细胞凋亡。
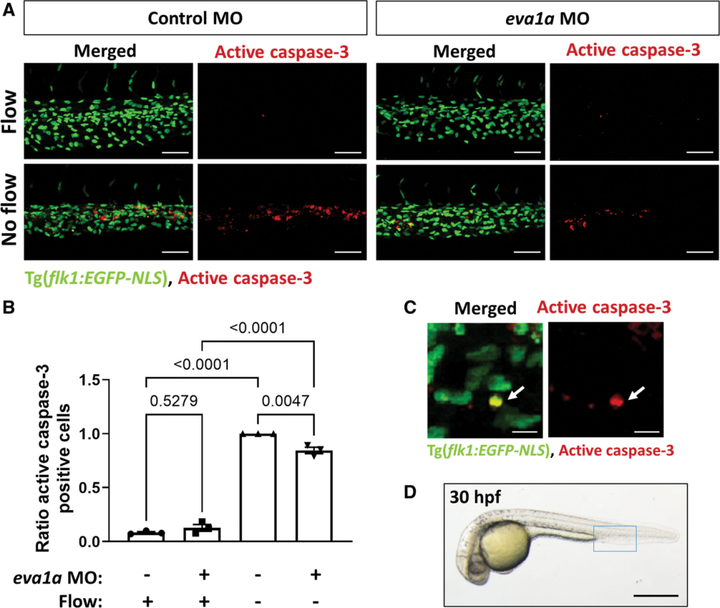
图3 EVA1A 在斑马鱼体内促进内皮细胞凋亡。
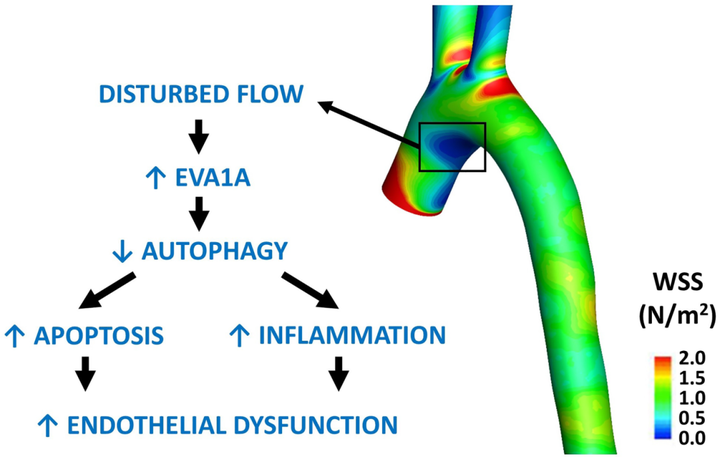
图4 图形概要
总之,该研究进一步证明了 EVA1A 在猪和小鼠主动脉以及人内皮细胞中被促动脉粥样硬化 DF 上调了mRNA 和蛋白水平。从功能上讲,在模拟人动脉的 DF 条件下,EVA1A 促进人 ECs 的凋亡并增加 ECs 通透性和炎症激活。因此,EVA1A 介导 DF 对 ECs 功能障碍的影响,这先于动脉粥样硬化斑块的发展。从机制上讲,在暴露于 DF 而不是 UF 的 ECs 中,EVA1A 有助于减少自噬通量,从而导致 ECs 凋亡增加。,研究证明, EVA1A 是由 WSS 方向的变化而不是幅度诱导的,并确定促动脉粥样硬化转录因子 TWIST1 是 EVA1A 的上游调节因子。未来有必要对 EVA1A 功能进行更详细的分析,以更好地了解其在血管健康和疾病中的作用及其作为心血管疾病治疗靶点的潜在用途。
参考文献:Canham L, Sendac S, Diagbouga MR, Wolodimeroff E, Pirri D, Tardajos Ayllon B, Feng S, Souilhol C, Chico TJA, Evans PC, Serbanovic-Canic J. EVA1A (Eva-1 Homolog A) Promotes Endothelial Apoptosis and Inflammatory Activation Under Disturbed Flow Via Regulation of Autophagy. Arterioscler Thromb Vasc Biol. 2023 Apr;43(4):547-561. doi: 10.1161/ATVBAHA.122.318110. Epub 2023 Feb 16. Erratum in: Arterioscler Thromb Vasc Biol. 2023 Jun;43(6):e230. doi: 10.1161/ATV.0000000000000163. PMID: 36794585; PMCID: PMC10026973.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36794585/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。咨询热线:021-59945088
点击了解:仿血流剪切应力培养系统NK110-STD