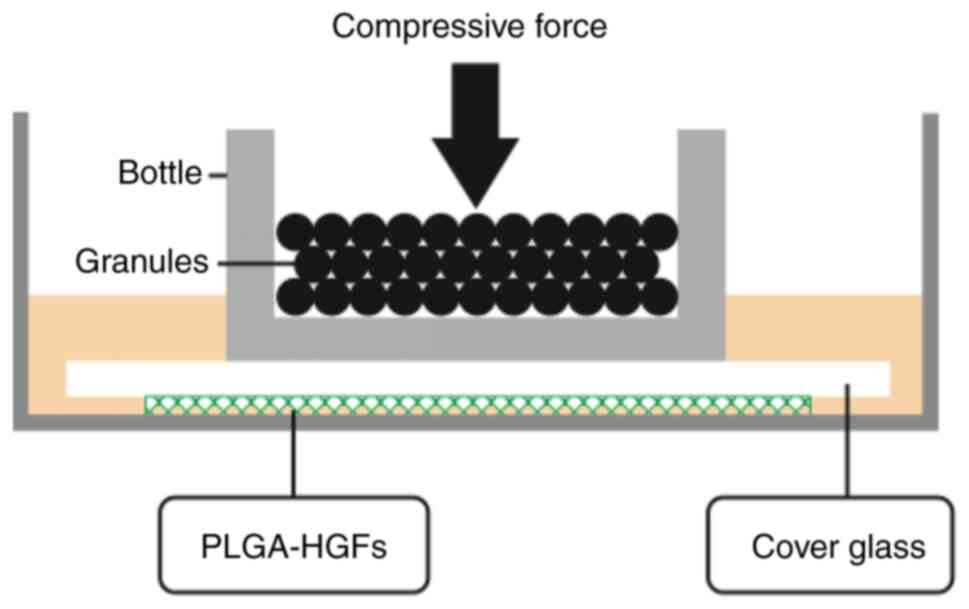
高脂血症影响人源牙周膜成纤维细胞力诱导的炎症反应,同时受到P. gingivalis-LPS的挑战
在肥胖患者中,促炎细胞因子,如TNFα、IL6、IL8以及IL1β的释放增加会导致生物学相关过程的失调,并促进低度全身性炎症。关于肥胖相关炎症潜在机制的研究集中在脂质代谢的紊乱以及由此导致的血清游离脂肪酸(FFA)水平升高,如饱和脂肪酸(棕榈酸,PA)、单不饱和脂肪酸(油酸,OA)。虽然它们与正常细胞功能相关,但高脂血症条件下两种脂肪酸都会影响几种细胞类型的炎症过程。
饱和脂肪酸(SFA)如PA已被证明可以通过多种途径激活促炎基因(TNFα、IL6、IL8、IL1α、IL1β)。OA等单不饱和脂肪酸(MUFA)主要通过平衡SFA诱导的炎症来降低促炎细胞因子(如TNFα和IL6)的水平。然而,在真皮成纤维细胞中,OA似乎具有促炎作用,导致COX2表达增加、ROS水平升高和氧化损伤。高脂血症是指血脂水平过高,在体内,其影响是基于过量的特定脂肪酸及其相互关系,这使体外研究复杂化。
与肥胖类似,牙周炎症也是一个全球性的健康问题,重度牙周炎患者也表现出低度全身炎症,促炎细胞因子水平升高。牙龈卟啉单胞菌(P. gingivalis)是一种革兰氏阴性专性厌氧菌,已被确定为牙周病发生发展的主要致病菌,其致病性归因于一系列毒力因子如菌毛、牙龈蛋白酶和脂多糖(LPS)。为了进行体外研究,牙龈卟啉单胞菌或其LPS通常用于模拟引起牙周炎的刺激。此外,牙龈卟啉单胞菌脂多糖(P. gingivalis LPS)可促进脂肪因子的促炎特性,可能导致肥胖相关炎症。然而,这两种疾病是否随后会影响正畸牙齿移动(OTM)目前知之甚少。
正畸治疗引起的复杂炎症信号级联反应主要由牙周膜成纤维细胞(PdLF)调节,PdLF是牙周组织中的主要细胞类型,位于牙根和牙槽骨之间。当牙齿受到机械应力时,触发的无菌性短暂炎症由PdLF特异性调节,特别是促炎细胞因子(如IL6、IL8、PGE2和TNFα)的表达和分泌是PdL压缩侧的特征,而抗炎细胞因子(如IL10)的释放在拉伸侧更为突出。
然而,牙周炎是否对正畸力诱导的炎症组织反应调节的肥胖相关变化有影响尚未得到研究。基于此,德国耶拿大学附属医院口腔正畸科、亚琛工业大学附属医院口腔正畸科的一项实验曾旨在:(1)研究脂肪酸模拟的高脂血症状况是否影响HPdLF在调节对压缩刺激的炎症反应方面的功能;(2)解决由于P. gingivalis LPS 给药引起的变化。鉴于患有牙周炎的肥胖患者比例不断增加,但他们仍然希望进行正畸治疗,该研究提供了有关生物学背景的初步信息。

首先,为了研究高脂血症PA和OA水平对HPdLF调节功能的影响,进行了THP1细胞粘附测定(图1 a、b),分析了在PA和OA中培养的HPdLF上贴壁Alexa488标记的THP1细胞的数量,仅用牛血清白蛋白(BSA)孵育的细胞用作对照。结果发现,在PA孵育的HPdLF中THP1细胞数量增加(图1 a、b)。与对照相比,OA培养导致相似数量的贴壁THP1单核细胞。这表明PA尤其会促进HPdLF的炎症反应。
接着研究了用脂肪酸培养是否会影响HPdLF对6小时机械压缩(7.13 g/cm²)的反应,此时几种细胞因子的表达和分泌已经增加。虽然压缩诱导对照和PA处理组的HPdLF中THP1细胞粘附增加(图1 a、b),但补充OA阻碍了压缩诱导的THP1粘附增加。这些数据表明,OA限制了6小时压缩刺激的炎症反应。
接下来,为了进一步分析脂肪酸培养的HPdLF的炎症反应,对细胞因子和炎症标志物TNFα、IL1α、IL1β、IL1RA、IL6、IL8和COX2的编码基因进行了定量PCR (图1 c、d)。
实验检测到IL1β、IL1RA和IL8的基线水平没有变化,而TNFα在两种脂肪酸条件下均降低(图1 c)。此外,OA培养物中IL1α和IL6水平显著降低(图1 c),PA培养物中COX2表达增加(图1 d)。无论培养条件如何,在6小时的压缩刺激下,大多数基因的表达量都有所增加(图1 c、d)。然而,与对照相比,PA和OA培养物中压缩诱导的COX2表达增加显著更高(图1 d)。
此外,脂肪酸处理后IL6基线水平无明显变化。然而,压缩刺激促进了对照和PA培养组中IL6的分泌,但在OA组没有(图1 e)。相比之下,无论是脂肪酸处理还是机械压缩,IL8的分泌没有改变(图1 f)。还检测到用PA处理的HPdLF中PGE2的分泌(图1 g),而机械压缩增加了PA培养组PGE2水平,并使OA培养组中PGE2水平高于检测限。
由于IL6而不是PGE2对于单核细胞分化为巨噬细胞非常重要,因此,对炎症标志物的分析支持了上述THP1测定的结果。
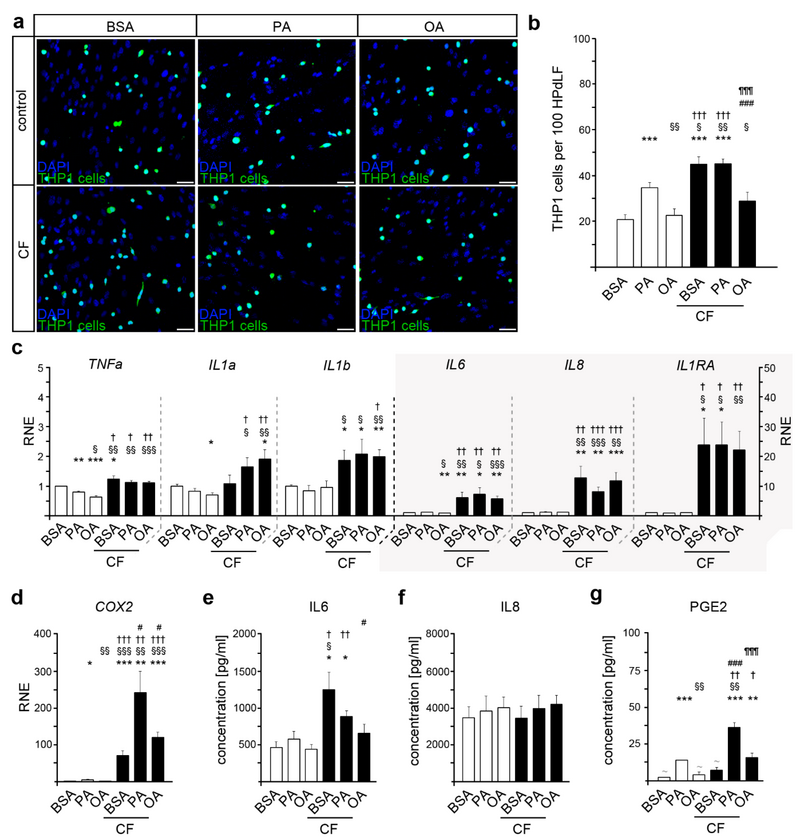
图1 棕榈酸和油酸影响人牙膜成纤维细胞(HPdLF)对6小时压缩力(CF)的炎症反应。
最后,为了模拟牙龈卟啉单胞菌感染,用适当的脂多糖刺激HPdLF 24小时。与未刺激的对照相比,LPS刺激导致THP1细胞粘附增加(图1 b,图2 a、b),这在LPS刺激的PA培养物中也可以检测到。此外,与各自对照相比,LPS刺激的PA培养物中THP1贴壁细胞的数量明显更多(图2 a、b)。施加压缩刺激后,在所有LPS刺激的HPdLF中THP1细胞粘附显著增加(图2 a,b),而PA培养物中,THP1贴壁细胞的增加显著更高。
COX2表达的定量分析显示,用LPS刺激与脂肪酸刺激没有相关差异(图2 c),然而,与非LPS刺激的HPdLF相比,其转录水平显著更高。IL6和IL8的表达也发生了类似的变化(图2 c),与各自的未刺激条件相比(与图1 c),LPS的应用导致BSA对照、PA培养和OA培养的HPdLF中其表达显著上调。压缩力作用下,COX2和IL6转录值增加,但IL8没有(图2 c),此外,IL6水平在脂肪酸刺激下表现出显著差异,在OA培养中表达降低。
对培养基中分泌蛋白的进一步分析显示,在机械应力和LPS刺激的PA培养物中PGE2显着增加(图2 d)。此外,LPS刺激的BSA对照中压缩诱导的IL6分泌水平增强,但没有检测到IL8的增强(图2 d)。当细胞额外暴露于PA时,IL6细胞因子释放的增加甚至更高,这进一步支持了PA对HPdLF在机械应力、细菌、应激条件下的炎症反应的调节作用。此外,与未受到牙龈卟啉单胞菌LPS刺激的HPdLF相比,在LPS刺激的PA和OA培养物中检测到的IL6和IL8分泌水平显著更高。
这些数据表明,用PA处理的机械压缩下的HPdLF的炎症反应增加。此外,当细胞受到引起牙周炎的细菌化合物的额外刺激时,炎症应激反应更加明显。
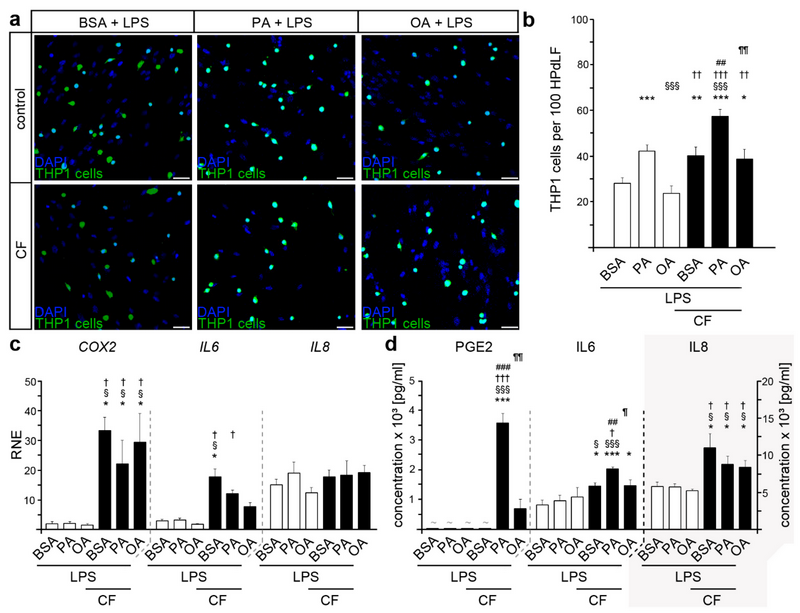
图2 用从牙龈卟啉单胞菌获得的LPS刺激压缩条件下棕榈酸培养的HPdLFs导致过度的免疫反应。
该研究提供了关于肥胖相关高脂血症如何影响体外压缩应力下牙周膜成纤维细胞在调节炎症反应的功能的新信息。机械应力诱导的炎症通过棕榈酸增强,当细胞受到牙龈卟啉单胞菌脂多糖的额外刺激时,炎症进一步增加。因此,这项研究提供了关于细胞因子调节变化的第一个信息,这些变化可能与越来越多的患有牙周炎的肥胖患者的正畸牙齿移动有关。
参考文献:Symmank J, Appel S, Bastian JA, Knaup I, Marciniak J, Hennig CL, Döding A, Schulze-Späte U, Jacobs C, Wolf M. Hyperlipidemic Conditions Impact Force-Induced Inflammatory Response of Human Periodontal Ligament Fibroblasts Concomitantly Challenged with P. gingivalis-LPS. Int J Mol Sci. 2021 Jun 4;22(11):6069. doi: 10.3390/ijms22116069. PMID: 34199865; PMCID: PMC8200083.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34199865/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。