拉伸导致细胞应激和原代羊膜细胞中Nrf2的下调
早产现象是造成新生儿发病与死亡的主要原因,早产占所有分娩数的5%-15%。在正常妊娠期间,胎膜(由外层的平滑绒毛膜和内层的羊膜组成)必须保持完整性,直至分娩。虽然胎膜常在分娩时破裂,但在此之前,生物化学和生物物理变化被认为会减弱胎膜。膜破裂前可见的生化变化包括炎症和氧化应激,它们在膜弱化中起到很大的作用。子宫内氧化应激累积会加速炎症的积累,导致细胞外基质成分降解,从而导致胎膜变弱。作为氧化应激和炎症的诱导剂,拉伸力在胎膜弱化过程中也很重要。
尽管与分娩相关的研究较少,但转录因子NFE2相关因子2(Nrf2)是一种参与调节DNA转录、细胞存活和炎症调节的蛋白质复合物。Nrf2已成为抗氧化反应中的关键转录因子,并与氧化应激相关的毒性和慢性疾病有关。虽然已知Nrf2可由ROS和细胞应激激活,但过度的应激条件(如脓毒性休克和高水平的氧化应激)会矛盾地损害Nrf2的表达,导致炎症和组织损伤增加。已证明Nrf2缺乏与核因子-kB(NF-kB)介导的炎症有关。然而,Nrf2也随分娩而降低,其活化会降低细胞因子IL-6的表达。但是目前,拉伸对Nrf2活性的影响尚未在胎膜的羊膜细胞中专门探索。由于高水平的氧化应激和增加的炎症与胎膜的减弱有关,因此Nrf2的作用,特别是其下调,与此有关。
基于此,在美国夏威夷大学马诺阿分校医学院解剖学、生物化学与生理学系,韦恩州立大学医学院等团队的一项研究中,旨在确定体外拉伸对羊膜上皮细胞应激和Nrf2的影响。实验假设体外拉伸会诱导细胞应激反应,激活促炎介质;ROS,HMGB1和NF-kB,同时下调Nrf2。 由于其在细胞保护中的作用,阐明体外拉伸对Nrf2的影响可以深入了解其在胎膜中的作用。

拉伸诱导细胞应激反应
前期已经证明对人羊膜上皮细胞(hAECs)的拉伸可以增加促炎细胞因子的产生,因此实验进一步表征了由这种刺激诱导的hAECs的细胞反应。体外拉伸装置设置为20% 的循环拉伸和释放实验持续4、8和16小时,间隔27秒拉伸幅度为20%,然后将拉伸释放7秒至0%。乳酸脱氢酶(LDH)活性的速率是细胞应激的非特异性标志物。结果表明,拉伸4 h显著提高了LDH活性(图1 A)。由于LDH数据提供了拉伸引起细胞应激的证据,因此研究了拉伸对危险相关分子模式分子HMGB1的直接影响。在hAEC拉伸4 h 的条件培养基中,HMGB1分泌量显著增加(图1 B)。由于hAECs显示细胞在拉伸后变得应激,因此通过用免疫荧光测量NF-kB p65亚基易位到细胞核来测量其对促炎NF-kB级联反应的影响。结果发现,hAEC拉伸4 h 显著增加了NF-kB p65亚基核易位(图1 C)。
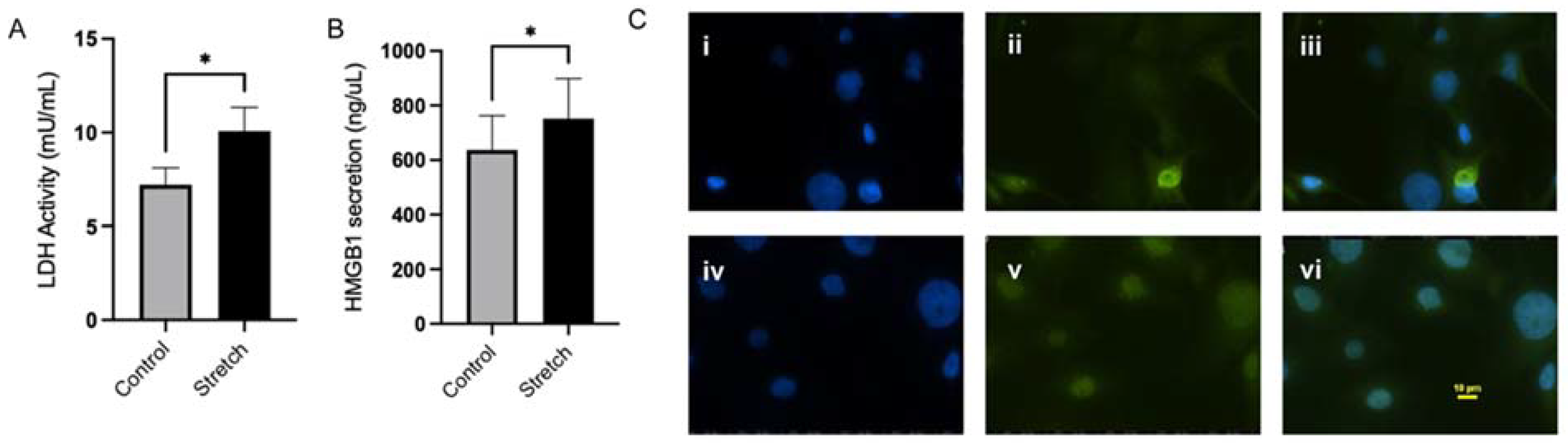
图1 机械拉伸增加了LDH活性,HMGB1分泌和NF-kB的活化。
(A)动力学测量的LDH活性(mU/μL)随着拉伸而增加。(B)ELISA定量拉伸4小时和未拉伸hAECs的细胞培养上清液HMGB1(ng/μL)的含量。(C)hAECs中p65蛋白核定位的免疫荧光分析。(i,ii)对照原代羊膜上皮细胞的DAPI-蓝(1μg/ mL)和p65(1/500)染色。(iv,v)分别对拉伸的原代羊膜上皮细胞进行DAPI和p65染色。(iii,vi)分别合并了对照细胞和拉伸细胞的 DAPI 和 p65 信号。
Nrf2在人胎膜细胞中表达,并在hAEC分离和细胞培养后保持表达
Nrf2水平已被证明随着分娩在胎膜中降低。因此,实验使用模型系统研究拉伸对Nrf2表达的影响,试图确定在人类胎膜收集期的基础表达水平是否足够高,以便研究其调节机制。对收集的胎膜组织的定性免疫组织化学分析显示, 与 IgG(对照)染色相比,Nrf2在羊膜、绒毛膜和蜕膜细胞中表达强烈(图2 A)。在羊膜中,羊膜间充质细胞(hAECs)的Nrf2表达信号相对强于对照组(图2 C、D)。然而,hAEC和hAMC Nrf2信号都具有强大的核表达。然后,在收集的羊膜细胞中确认了Nrf2在基因水平上的表达,并将其与HeLa污染的羊膜上皮样细胞(WISH),胎盘组织和hAMCs中的Nrf2表达进行了比较(图2 E)。此外还测量了hAMCs的表达,因为免疫组织化学发现这些细胞具有强表达(图2 A)。hAECs和hAMCs的基因表达水平均低于WISH细胞系,但高于分离的胎盘组织。hAECs的Nrf2表达高于hAMCs。异硫氰酸荧光素(FITC)标记的Nrf2的免疫细胞化学分析进一步证实了细胞分离后 Nrf2 在 hAECs 中的表达(图2 F-H)。

图2 hAECs在人胎膜组织采集和随后的细胞分离和培养后强烈表达Nrf2。
(A)Nrf2在胎膜中的代表性免疫组织化学图像,放大倍数20×Nrf2(B)IgG对照。(C)羊膜层Nrf2和(D)IgG染色组织羊膜层IgG染色组织。(E)归一化为GAPDH的Nrf3表达的qPCR分析。(F-H)hAECs中 Nrf2 表达的免疫细胞化学,分别放大 60x FITC标记的 Nrf2、DAPI 染色和合并图像。
体外拉伸下调人羊膜上皮细胞Nrf2的表达
已经确认Nrf2在hAECs 组织和细胞水平上的稳健基线表达(图2 D),因此实验使用这种羊膜细胞类型来确定机械拉伸对该转录因子的影响。hAEC最初进行 20% 的循环拉伸持续4、8和16小时。拉伸4 h后,与未拉伸细胞的对照相比,细胞内 Nrf2的水平显著降低(图3 A)。拉伸8和16 h后,Nrf2表达降低,但Nrf2蛋白表达无显著差异,因为在未拉伸对照条件下,Nrf2表达也降低。由于20%循环拉伸持续4 h导致Nrf2表达与对照条件相比显著降低,因此研究了Nrf2易位到细胞核的影响,结果表明,机械拉伸使细胞核Nrf2表达显著降低(图3 B)。这些结果证实了机械拉伸导致Nrf2水平的降低。由于Nrf2在拉伸后被下调,而ROS的产生可以下调Nrf2活性,因此在拉伸后测量了ROS的产生,结果表明,拉伸后Nrf2表达的降低伴随着ROS产生的增加(图3 C)。

图3 拉伸显著降低Nrf2表达。
(A)Nrf2(100 kDa)和β-肌动蛋白(42 kDa)的全细胞裂解物。(B)20% 循环拉伸4小时后Nrf2(100 kDa)和层粘连蛋白B1(70 kDa)表达的核裂解物蛋白质印迹。(C)通过DCF(nM)量化ROS的生成,其随拉伸而增加。
萝卜硫素在拉伸的羊膜细胞中挽救独立于 ROS 的 Nrf2
萝卜硫素已被证明在特定的浓度下通过激活Nrf2信号通路能够引发一连串抗氧化酶的产生,可有效减轻氧化应激和组织/细胞损伤。由于Nrf2被认为在与早产相关的促炎途径中发挥作用,因此对1、2 μM萝卜硫素处理的细胞进行机械拉伸,以研究其对Nrf2易位和活性的影响。首先,利用LDH活性量化萝卜硫素处理对细胞毒性的影响。在拉伸或对照条件下,0、1或2 μM萝卜硫素处理后LDH活性没有显著差异(图4 A)。此外,在hAECs拉伸4 h后,1 μM萝卜硫素处理提高了57.8% 的核Nrf2水平,而2 μM萝卜硫素处理导致核Nrf2水平显著增加122.2%(图4 B)。由于萝卜硫素改善拉伸诱导Nrf2下调,因此还研究了其对ROS产生的影响。萝卜硫素处理对hAECs的ROS产生没有显著影响,因为在所有萝卜硫素浓度下,ROS随拉伸而显著增加(图4 C)。
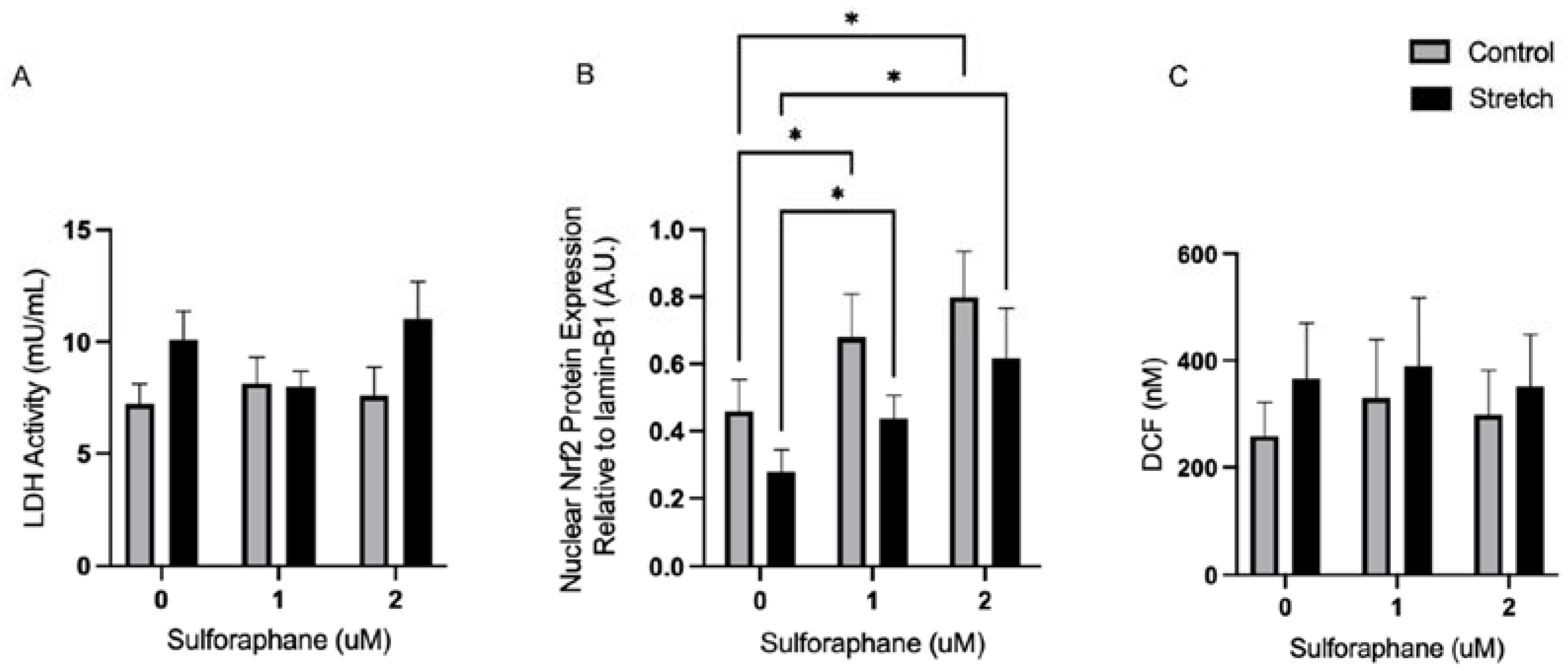
图4 萝卜硫素拯救了独立于拉伸的拉伸介导的Nrf2下调。
(A)动力学测量用萝卜硫素处理的LDH活性。(B)萝卜硫素处理下核Nrf2蛋白相对于层粘连蛋白B1的表达。(C)用萝卜硫素处理的DCF生成。

图5 Nrf2和NF-kB活性取决于细胞应激水平的综述。
(A-C)转录因子Nrf2和NF-kB的激活取决于细胞应激的水平。(A)说明没有明显压力的正常生理状况。泛素化的Nrf2与KEAP1结合,NF-kB-p65与IkB结合,从而抑制它们易位到细胞核中。(B)中度压力的影响,例如怀孕的第三个月。Nrf2与KEAP1分离,这允许核易位并与ARE基序特异性基因结合。NF-kB-p65仍然与细胞质中的IkB结合。(C)严重的压力导致分娩和细胞伸伸。升高的应激导致KEAP1-Nrf2复合物的移除和IKKB的激活,从而抑制了IkB的抑制,激活了NF-kB-p65并导致二聚体易位到细胞核中并与RELB基序特异性基因结合。(D、E)人羊膜上皮细胞(D)未拉伸,(E)拉伸20%。拉伸的细胞增加细胞质ROS,HMGB1的分泌和LDH活性。还显示总Nrf2和核Nrf2减少,核NF-kB-p65增加。
该研究重点是了解了妊娠末期拉伸对胎膜的作用。它是第一个确定机械拉伸对转录因子Nrf2表达的影响以及HMGB1分泌和细胞内ROS水平变化的,特别是在hAECs中(图5)。先前的工作表明,拉伸会导致hAECs分泌的IL-6和PBEF增加,因此结合新数据,支持了这种形式的细胞应激刺激可以在羊膜中促炎的一般论点。为了进一步支持研究结果,先前已经表明,沉默原代羊膜细胞中的Nrf2会增加促炎细胞因子IL-6和趋化因子IL-8的表达和分泌。因此,在该研究中,萝卜硫素对Nrf2降低的拯救表明,Nrf2的激活可以被操纵来产生抗炎和抗氧化过程,这些过程对及时分娩和健康的妊娠结果很重要。
参考文献:Padron JG, Norman Ing ND, Ng PK, Kendal-Wright CE. Stretch Causes Cell Stress and the Downregulation of Nrf2 in Primary Amnion Cells. Biomolecules. 2022 May 31;12(6):766. doi: 10.3390/biom12060766. PMID: 35740891; PMCID: PMC9220942.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35740891/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。