瑞戈非尼通过抑制肿瘤相关巨噬细胞中的p38激酶/Creb1/Klf4轴增强抗肿瘤免疫力
程序性细胞死亡受体-1(PD-1)/程序性细胞死亡配体-1(PD-L1)通路因其在调节抗肿瘤免疫调控中的作用而被广泛研究。单抗 PD-1 或单抗 PD-L1 免疫检查点抑制剂(ICI)治疗已被批准用于10 多种晚期癌症,与其他免疫调节剂、靶向治疗或细胞毒性化疗的联合治疗方案可进一步提高不同癌症类型的总生存期(OS)或无病进展生存期(PFS)。
对于肝细胞癌(HCC),通过抑制血管内皮生长因子(VEGF)通路的抗血管生成作用是所有已批准的肝癌多激酶抑制剂(MKI)(一线治疗药物索拉非尼和仑伐替尼,二线药物瑞戈非尼和卡博替尼)的常见抗肿瘤机制,并且广泛研究了这些MKIs与ICI联合用于HCC的治疗。此外,临床前研究表明,较高剂量的MKI可能通过诱导缺氧和募集肿瘤相关巨噬细胞(TAMs)或其他抑制细胞来而矛盾地诱导免疫抑制。因此,确定靶向药物的最佳免疫调节作用对于开发联合免疫疗法至关重要,既可以提高治疗指数,又可以根据其生物学有效性和临床相关剂量调整靶向药物的使用。
MKI 瑞戈非尼已被批准作为晚期HCC以及难治性结直肠癌和胃肠道间质瘤的二线治疗药物,但其推荐剂量(每天160 mg,持续21天,然后休息7天)的使用经常受到相关不良事件的限制,包括手足皮肤反应、腹泻和高血压。瑞戈非尼和抗PD-1药物(纳武利尤单抗)联合用药在50例经过大量预处理的晚期胃癌或结直肠癌患者中显示出40%的客观缓解率,而单独使用瑞戈非尼或纳武利尤单抗的缓解率低于10%。80 mg/天的瑞戈非尼在这种组合中耐受性良好,而推荐剂量(160 mg/天)产生明显的皮肤毒性和其他不良事件,但疗效没有增加。研究证明,亚微摩尔范围内的瑞戈非尼可能诱导M1巨噬细胞极化和增加CD8+ T细胞的增殖和活化。在体内研究中,使用低剂量瑞戈非尼3-5 mg/kg /天,相当于单药推荐剂量的约50%,显示出与抗PD-1治疗的协同抗肿瘤疗效。上述研究表明,瑞戈非尼的最佳免疫调节剂量可能低于推荐的单药治疗剂量,应进行优化以提高其安全性并促进联合治疗的发展。
基于此,国立台湾大学医学院肿瘤医学研究所、国立阳明大学分子医学、台北荣民总医院肿瘤内科的一项研究旨在建立相关的临床前模型来表征瑞戈非尼的免疫调节作用,并探索瑞戈非尼对肝细胞癌的生物学有效剂量。低剂量瑞戈非尼(体外≤1μM,体内5 mg/kg/天)可通过巨噬细胞向M1表型极化来增加细胞毒性T细胞功能和抗肿瘤免疫。此外,p38丝裂原活化蛋白激酶(p38MAPK)通路被确定为介导瑞戈非尼免疫调节作用的一种分子机制。
瑞戈非尼的免疫调节作用有助于其体内抗肿瘤作用
瑞戈非尼5 mg/kg /天在原位和皮下免疫功能肝癌模型中均发挥抗肿瘤作用。瑞戈非尼增加了CD4+ 和CD8+ T细胞对肿瘤的浸润,增加了T细胞活化、抗原呈递和巨噬细胞活化相关的基因的表达,并抑制了血管生成相关的基因。虽然瑞戈非尼诱导癌细胞凋亡是剂量依赖性的,但较高剂量的瑞戈非尼抑制了体外T细胞增殖和活化,表明较高剂量的瑞戈非尼可能与更好的免疫调节作用无关。
然后将瑞戈非尼的抗肿瘤作用与小鼠抗VEGFR2抗体DC-101的抗肿瘤作用在原位肝癌模型中进行比较,以确定独立于抗VEGFR2作用的可能的免疫调节作用。虽然瑞戈非尼和DC-101都抑制肿瘤血管生成,但瑞戈非尼诱导更多的T细胞浸润到肿瘤中,并且具有更好的抗肿瘤作用(图1 A)。瑞戈非尼调节多种相对不受VEGFR2抑制影响的免疫相关通路,如与防御反应和白细胞迁移相关的通路(图1 B、C),并增加肿瘤中活化的CD8+ T细胞(图1 D)。瑞戈非尼降低了体内TAMs的总数(图1 D),并在体外诱导M1/M2巨噬细胞的凋亡。然而,流式细胞术和多重免疫荧光染色研究均显示M1/M2比值增加(图1 D、E)。相比之下,DC-101增加了TAMs的总数,并且不影响巨噬细胞极化。
因此,研究假设巨噬细胞极化的调节可以解释瑞戈非尼的免疫调节作用,而与其VEGFR2抑制作用无关。瑞戈非尼和DC-101对巨噬细胞功能关键信号通路调控的差异作用支持了这一假设。瑞戈非尼在M1特征、IL-12通路、对IFN-γ的反应和肿瘤坏死因子(TNFs)靶点方面诱导了更显著的变化(图1 F)。瑞戈非尼和DC-101在分析的其他免疫细胞中没有显著差异,例如树突状细胞,调节性T细胞或髓源性抑制细胞。

图1 瑞戈非尼具有免疫调节作用,其独立于抗血管生成。
瑞戈非尼通过调节巨噬细胞极化增加CD8+ T细胞的增殖和活化
为了测量瑞戈非尼对巨噬细胞极化和T细胞功能的影响,用瑞戈非尼预处理小鼠骨髓来源的巨噬细胞(BMDMs)1小时,然后分别用IFN-γ+脂多糖(LPS)(M1表型)或白细胞介素-4(IL4)(M2表型)极化24小时(图2 A)。亚微摩尔剂量的瑞戈非尼增加了M1巨噬细胞中的M1标志物(TNFα、IL6、MHC II),并抑制了M2巨噬细胞中的M2标志物(Arg1,CD206)(图2 B)。将小鼠脾细胞与BMDMs共培养,通过T细胞增殖和IFN-γ分泌检测药物治疗前后巨噬细胞调节的CD8+ / CD4+ T细胞功能(图2 C)。瑞戈非尼处理的BMDMs共培养增加了 T 细胞的增殖和 IFN-γ分泌(图2 D、E)。以上数据表明,调节巨噬细胞功能,特别是抑制M2极化,可能在瑞戈非尼的免疫调节作用中起关键作用。
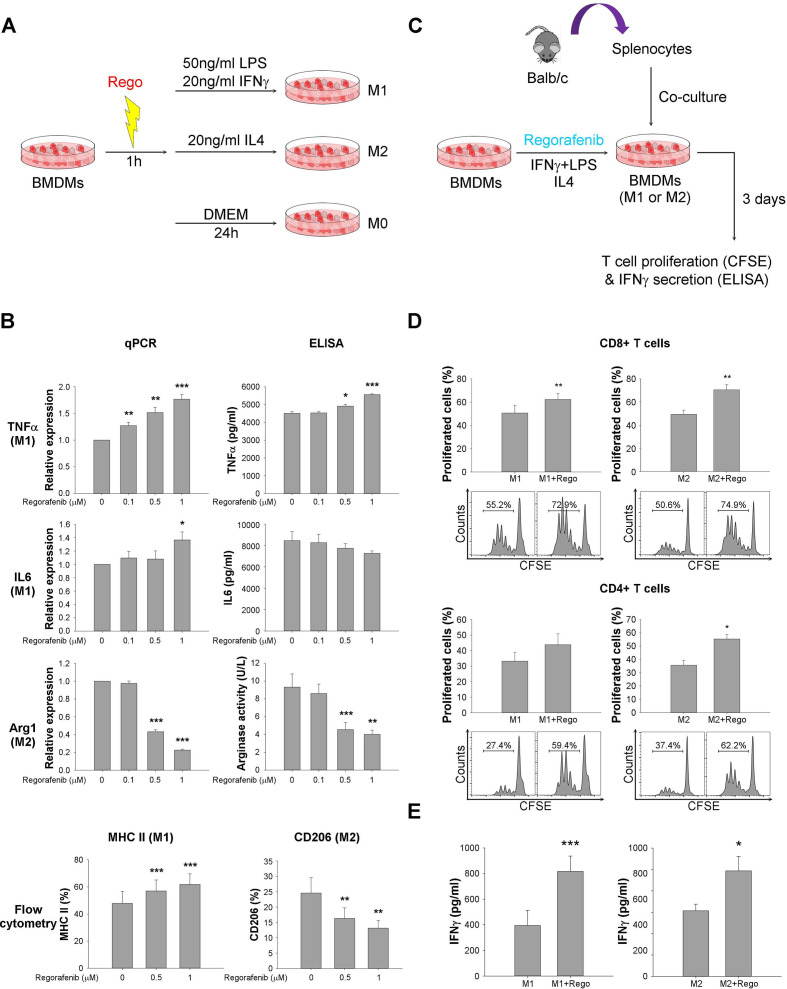
图2 瑞戈非尼通过调节巨噬细胞极化增加CD8+ T细胞的增殖和活化。
为了进一步阐明瑞戈非尼可能抑制M2巨噬细胞极化的分子机制,接下来分析了瑞戈非尼处理的BMDMs中代表性细胞激酶的RNA表达和活性。瑞戈非尼增加了与M1表型相关的基因表达,并抑制了M2极化的多种介质(图3 A、B),并可抑制可能参与免疫调节的多种细胞激酶(图3 C)。在瑞戈非尼调控的激酶中,p38MAPK受到特别关注,因为发现p38MAPK活化除了在调节细胞凋亡和对氧化应激的反应方面具有公认的作用外,还促进M2巨噬细胞极化。因此,选择p38MAPK进行进一步的机械探索。
接下来,分析了瑞戈非尼处理的巨噬细胞中下调的基因,以寻找瑞戈非尼调控的潜在介质。结果显示,瑞戈非尼可能调节多种转录因子,包括Klf4和cAMP反应元件结合蛋白1(Creb1),已知它们对巨噬细胞活性/存活至关重要。有趣的是,p38MAPK已被注意到可以调节Creb1磷酸化。因此,实验假设瑞戈非尼通过抑制p38MAPK活性来抑制巨噬细胞的M2极化,从而抑制p38MAPK调节的Creb1磷酸化以下调Klf4转录(图3 D)。瑞戈非尼处理的小鼠BMDMs和J774A.1巨噬细胞系中,其抑制p38MAPK和Creb1磷酸化,以及Klf4和Ccl7(与M2极化相关的细胞因子)的表达(图3 E)。通过 shRNA 敲低 MAPK14或 p38MAPK 抑制剂 SB202190(图3 F)抑制p38MAPK-Creb1-Klf4 通路对M2标记物的调控效果相似。瑞戈非尼抑制Creb1与Klf4启动子的cAMP响应元件的结合验证了瑞戈非尼调节Creb1与Klf4启动子的结合(图3 G)。
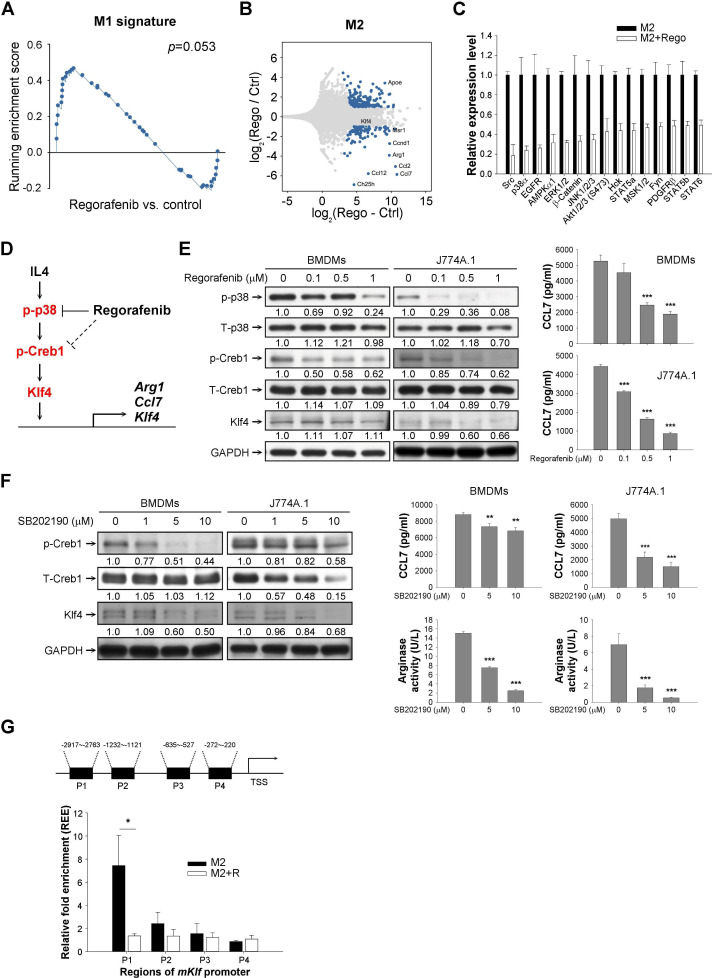
图3 瑞戈非尼可以通过抑制p38MAPK-Creb1-Klf4通路来调节巨噬细胞极化。
最后,通过抗原特异性细胞毒性T细胞的过继转移和与抗PD-1疗法的联合治疗,进一步探讨了瑞戈非尼对适应性抗肿瘤免疫的影响。瑞戈非尼显著增强了过继转移的CD8 T细胞的抗肿瘤能力,这与肿瘤中CD8 T细胞增加有关。另一方面,过继转移的CD8+ T细胞在荷瘤小鼠的外周血,脾脏或淋巴结中的分布与添加瑞戈非尼没有差异。在肝癌模型中,与单药治疗相比,瑞戈非尼和抗PD1疗法的组合在肿瘤生长(图4 A)和生存(图4 B)方面显示出协同抗肿瘤能力。在动物模型中,单独使用瑞戈非尼或瑞戈非尼加抗PD疗法可调节与白细胞增殖和迁移相关的多个基因。此外,与单独使用瑞戈非尼或抗PD1疗法相比,瑞戈非尼-抗-PD1疗法的组合诱导了独特的基因表达模式(图4 C),并涉及多种免疫相关通路(图4 D)。上述数据支持该研究提出的瑞戈非尼调节抗肿瘤免疫的机制(图4 E)。

图4 瑞戈非尼与抗程序细胞死亡-1(抗-PD1)疗法之间的抗肿瘤协同作用。
综上所述,瑞戈非尼可通过调节巨噬细胞极化增强HCC的抗肿瘤免疫力。这种更安全和生物学上有效的瑞戈非尼剂量将为联合治疗提供更好的治疗指标。未来将需要优化临床前模型,合理设计基于ICI的联合方案,以及不同免疫调节剂之间潜在抗肿瘤协同作用的机理探索。
参考文献:Ou DL, Chen CW, Hsu CL, Chung CH, Feng ZR, Lee BS, Cheng AL, Yang MH, Hsu C. Regorafenib enhances antitumor immunity via inhibition of p38 kinase/Creb1/Klf4 axis in tumor-associated macrophages. J Immunother Cancer. 2021 Mar;9(3):e001657. doi: 10.1136/jitc-2020-001657. PMID: 33753566; PMCID: PMC7986673.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33753566/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。