力诱导的一氧化氮促进小鼠正畸牙齿移动期间的成骨活性
正畸牙齿移动(OTM)是一个机械力诱导牙周组织改建的过程。压力侧的牙槽骨吸收和张力侧新骨再生的平衡决定了 OTM 的速度。一氧化氮(NO)已被证明对骨代谢有影响。NO 供体对成骨细胞的生长和骨形成具有有益的影响。同时,它们会降低破骨细胞的活性。研究指出,牙周组织在正畸力的作用下产生 NO。NO 的前体(L-精氨酸)加速了大鼠的 OTM,增加了压力侧破骨细胞的数量和Howship腔隙,而抑制 NO 产生的 NOS(一氧化氮合酶)抑制剂会减少 OTM。因此,NO 也对 OTM 产生了重大影响。
目前已经发现了三种 NOS 亚型:神经元型(nNOS)、内皮细胞型(eNOS)和诱导型(iNOS)。已经证明,eNOS 介导张力侧的骨形成,而 iNOS 介导压力侧的骨吸收。eNOS 和 iNOS 似乎是 OTM 过程中骨重塑的关键调节因子,它们主要分布在骨细胞中。与骨细胞不同,牙周膜细胞在早期 OTM 阶段更倾向于成为机械传感器,与 NO 信号传导有关。人牙周膜干细胞(hPDLSCs)是间充质干细胞(MSCs),对维持牙周组织的稳态至关重要。先前的证据表明,hPDLSCs 参与 OTM 过程。循环拉伸力(CTF)促进 hPDLSCs 中成骨基因和蛋白质的表达,如碱性磷酸酶、RUNX2、osterix 蛋白和骨桥蛋白。此外,机械应变可以刺激 hPDLSCs 分化成成骨细胞。
在首都医科大学口腔医学院口腔正畸学教研室及全牙再生与口腔组织功能重建实验室小组的一项研究中报道了 hPDLSCs 可以产生 NO,NO 具有促进 PDLSCs 成骨分化的能力。在这项研究中,重点研究了模拟 OTM 的过程的机械拉伸力对 hPDLSCs 产生 NO 变化的影响,还发现了骨代谢的变化以及这一过程中涉及的潜在信号通路。

正畸力诱导体内 NO 产生和 NOS 表达
为了研究体内 OTM 过程中 NO 的产生,使用小鼠正畸力(30g)模型进行研究(图1 a)。施加力7天后,OTM 的 HE 和显微 CT 分析显示,第一磨牙向内侧移动。观察到远端牙周膜变宽,而近中端牙周膜受压(图1 b-d)。与对照组相比,NO2- 浓度在施加正畸力的小鼠血清中升高(图1 e)。
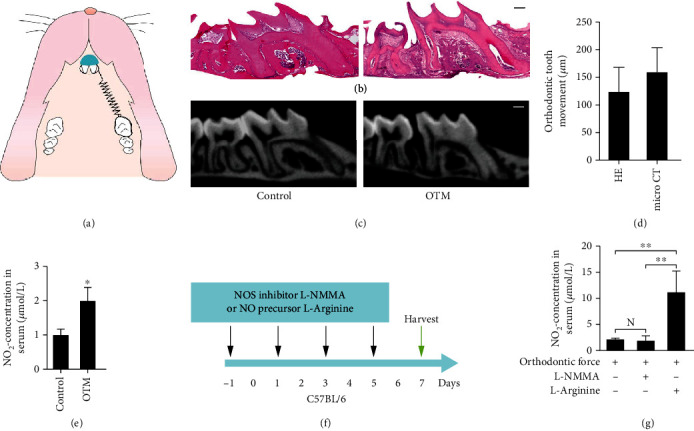
图1 正畸力诱导NO产生和NOS表达。
力诱导的 NO 调节 OTM 过程和骨形成
为研究力诱导的 NO 产生对 OTM 过程的影响,注射 NOS 抑制剂 L-NMMA 抑制其生成,并注射 NO 前体 L-精氨酸以增加 OTM 过程中的内源性 NO 生成(图1 f-g)。施加力7天后,测量上颌第一磨牙和第二磨牙之间的距离。与对照组相比,L-NMMA 对 NOS 的抑制作用缩短了 OTM 的距离。同时,注射L-精氨酸上调了 NO 水平并增加 OTM 的距离。
免疫组织化学染色显示,与 PBS 对照组相比,在 OTM 期间阻断内源性 NO 的产生可抑制张力侧牙周膜和牙槽骨中碱性磷酸酶阳性 hPDLSCs 和骨细胞的积累(图2 a、b、d)。为了进一步确认 NO 在 OTM 中的功能,注射了 L-精氨酸以提高小鼠的 NO 水平。结果显示,与 PBS 对照组相比,张力侧牙周膜和牙槽骨中碱性磷酸酶阳性 hPDLSCs 和骨细胞的积累增加(图2 a、c、d)。
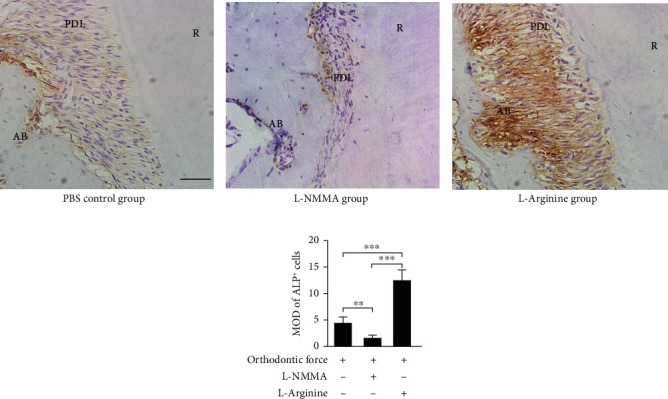
图2 在OTM期间,力诱导的NO可以调节张力侧的骨形成活动。
(a-c)远端张力侧的代表性免疫组织化学图像。(b、d)L-NMMA注射显著抑制牙周膜碱性表达,促进碱性磷酸酶的表达。
循环拉伸力在体外诱导 NO 生成和 NOS 表达
接下来,实验研究了 hPDLSCs 的 NO 产生,这在 OTM 的骨形成过程中非常重要。此外,通过免疫染色评估发现人 hPDLSCs 表达 eNOS 和 iNOS。为了研究 NO 产生的机制,对 hPDLSCs 施加循环拉伸力(10%伸长率,0.5 Hz,6、12、24 h),以在体外探索机械力对 NO 产生的影响。已经证明,hPDLSCs 在没有力刺激的情况下产生 NO。检测 hPDLSCs 的培养上清液中 NO2- 的浓度,结果发现,在12小时和24小时后显著增加(图3 a)。蛋白质印迹结果显示,eNOS 和 iNOS 蛋白表达上调,qPCR 结果显示相同的趋势(图3 b、c)。这些数据表明,施加 CTF 在 hPDLSCs 中促进 NO 生成,这可能对生物学功能产生影响。
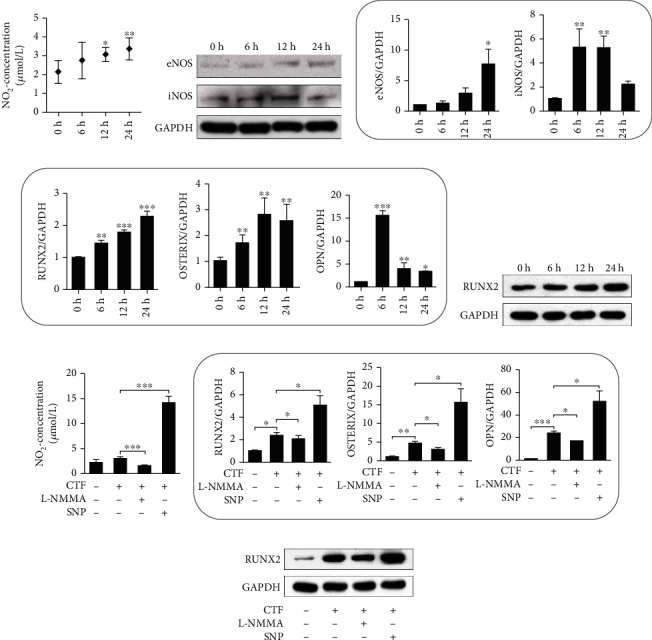
图3 循环拉力诱导NO产生和NOS表达来调节hPDLSC的成骨。
力诱导的 NO 可能会调节 OTM 期间张力侧的骨形成
实验假设 OTM 期间张力侧的骨形成可能是力诱导的 NO 通过 hPDLSCs 的成骨分化调控的。先前的研究表明,循环拉伸力促进了 hPDLSCs 的成骨分化。实验用 CTF 处理 hPDLSCs 持续0小时,6小时,12小时和24小时,qPCR 检测到 RUNX2,Osterix 和骨桥蛋白 mRNA 水平升高(图3 d)。RUNX2 的蛋白质印迹结果显示出相同的趋势(图3 e)。
为了研究不同浓度的 NO 对成骨的影响,用 L-NMMA 处理 hPDLSCs 以降低 NO2- 的浓度,结果发现在体外循环拉伸力下,外源 NO 供体硝普钠(SNP)增加 NO2- 的浓度(图3 f)。qPCR 结果显示,在 CTF 期间 NO 产生受到抑制时,RUNX2、Osterix 和骨桥蛋白 mRNA 表达降低,而在 CTF 期间促进 NO 生成时,它们的表达增加(图3 g)。RUNX2 的蛋白质印迹显示出相同的趋势(图3 h)。
hPDLSCs 中的力诱导的 NO 可能调控 PI3K/Akt 信号通路
为了研究力诱导的 NO 如何影响 hPDLSCs 的成骨,实验分析了 NO 下游通路 PI3K/Akt。刺激 hPDLSCs 后,p-PI3K、p-Akt 和活性 β-连环蛋白的表达水平上调(图4 a)。然后,用 PI3K 抑制剂 LY294002 处理 hPDLSCs,发现 p-PI3K、p-Akt 和活性 β-连环蛋白的表达水平下调(图4 b)。此外,用 NO 抑制剂 L-NMMA 处理 hPDLSCs,发现 L-NMMA 抑制了 CTF 处理下 hPDLSCs 中 PI3K/Akt 通路的促进(图4 c)。
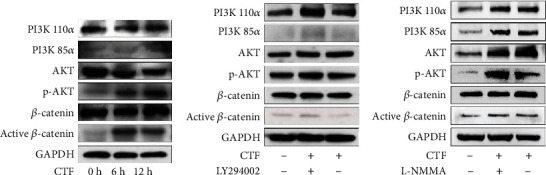
图4 PDLSCs中力诱导NO可以通过PI3K / Akt信号通路由iNOS调节。
由于 NO 在 OTM 中的功能作用尚未完全阐明,该研究证明,力诱导的内源性 NO 促进 PDLSCs 的成骨活性,有助于维持 OTM 期间牙槽骨的稳态。NO 是调节 OTM 过程所必需的,NO 水平的降低导致 OTM 距离缩短。随着对 NO 在 OTM 中的作用的认识的加深,可能会带来一种基于 NO 供体的 OTM 的加速治疗方法。
参考文献:Sun Y, Fu J, Lin F, Li S, Du J, Liu Y, Bai Y. Force-Induced Nitric Oxide Promotes Osteogenic Activity during Orthodontic Tooth Movement in Mice. Stem Cells Int. 2022 Sep 6;2022:4775445. doi: 10.1155/2022/4775445. PMID: 36110889; PMCID: PMC9470363.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36110889/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。