CD11b 和 Piezo1 之间的串扰介导巨噬细胞对机械信号的反应
机械信号存在于全身各个组织中,这些信号在影响细胞形态和功能方面发挥着重要作用。相比之下,尽管免疫细胞在整个身体(包括机械活性组织)中存在、起作用和迁移,但人们对这些机械力如何影响免疫细胞知之甚少。巨噬细胞是天然存在于组织中的先天免疫细胞,或在损伤或感染时从血液单核细胞募集到组织中。巨噬细胞功能的多样性源于它们对微环境中的信号可以做出动态响应能力。据报道,在不同程度的机械拉伸下,巨噬细胞会改变其形态、酶活性、增殖和激活状态,例如,循环拉伸可抑制炎性细胞因子IL-1β 的表达。然而,负责巨噬细胞机械转导的分子介质仍然难以捉摸。
在巨噬细胞中,整合素在调节各种细胞功能(如运动、吞噬作用和激活)中至关重要,并且还被认为在机械感觉中发挥作用。拉伸激活的离子通道,如 Piezo1,响应细胞膜张力的变化,并将外部物理刺激转导为电化学信号,同时影响信号转导和细胞行为。此外,Piezo1 活性被认为可增强整合素激活并调节肌动蛋白聚合。然而,整合素、Piezo1 的作用以及这些分子在巨噬细胞中的相互作用,特别是在拉伸机械转导的背景下,还有待研究。
基于此,在美国加利福尼亚尔湾分校生物医学工程系、分子结构生物学与生物化学系、化学工程与材料科学系课题组的一项研究中,探讨了循环单轴拉伸对巨噬细胞行为的影响,实验对小鼠骨髓来源的巨噬细胞(BMDMs)进行 IFNγ/LPS(促炎,称为 M1)或 IL4/IL13(促愈合,称为 M2)刺激,同时施加5%、10% 或 20% 的循环或静态单轴应变。研究发现表明可溶性和物理刺激协同作用以改变巨噬细胞功能,并指出CD11b和Piezo1在巨噬细胞机械拉伸感应中的关键作用。相关研究成果发表在 Frontiers in Immunology 期刊题为“Crosstalk Between CD11b and Piezo1 Mediates Macrophage Responses to Mechanical Cues”。

为了探索循环机械应变和可溶性刺激在调节巨噬细胞形态和功能方面的影响,使用单轴细胞拉伸装置、IFNγ/LPS 或 IL4/IL13 刺激的 BMDMs,将细胞暴露于1 Hz、20% 单轴应变下18小时。首先,实验分析了与静态对照相比,循环应变在调节巨噬细胞形态中的作用(图1 A),未受刺激的巨噬细胞表现出宽高比范围,没有明显的定向;IFNγ/LPS 刺激的巨噬细胞呈扁平圆形;而 IL4/IL13 刺激的巨噬细胞则被拉长。当暴露于循环单轴应变时,巨噬细胞在所有可溶性刺激条件下均表现出与单轴拉伸平行的排列(图1 A)。仅在暴露于循环应变的IFNγ/LPS刺激的巨噬细胞中观察到伸长的增加,这表明拉伸导致经典活化的巨噬细胞偏离其典型的圆形形态,而采用更细长的形态。这些结果表明,循环单轴拉伸导致巨噬细胞伸长,特别是在IFNγ / LPS刺激的条件下,并沿拉伸方向排列。
鉴于之前发现细胞伸长与伤口愈合增强和炎症反应减弱有关,实验接下来研究了循环机械拉伸在影响巨噬细胞功能中的作用。拉伸后,观察到未刺激巨噬细胞中炎症标志物 iNOS 或愈合标志物ARG1的表达没有变化(图1 B),这表明,拉伸及其对细胞形态的影响本身不能单独调节巨噬细胞的激活。然而,IFNγ/LPS的添加增强了iNOS的表达,并且在拉伸后表达显著降低,同样,在IL4/IL13 刺激下 ARG1 的表达随拉伸而降低(图1 B)。
然后,实验试图通过将 BMDMs 暴露于 5%、10% 和 20% 振幅的循环和静态拉伸来进一步表征巨噬细胞对机械应变反应的功能差异。与之前的结果类似,未受刺激的巨噬细胞在炎症标志物分泌方面与单独拉伸没有显著差异,但在IFNγ/LPS刺激下,在静态和循环拉伸下,无论应变幅度如何,巨噬细胞的炎症标志物TNFα、IL6和MCP1的分泌均显著减少。相比之下,在拉伸下IL4/IL13 刺激的 BMDMs 表现出愈合标志物的差异表达,具体而言,无论拉伸幅度如何,静态拉伸都会增加 ARG1 的表达,而循环拉伸的幅度增加导致 ARG1 表达降低。这些数据表明,可溶性刺激和拉伸应变协同作用以调节巨噬细胞的功能,并且不同的拉伸幅度一致地抑制炎症激活,而伤口愈合反应则取决于拉伸幅度的大小。
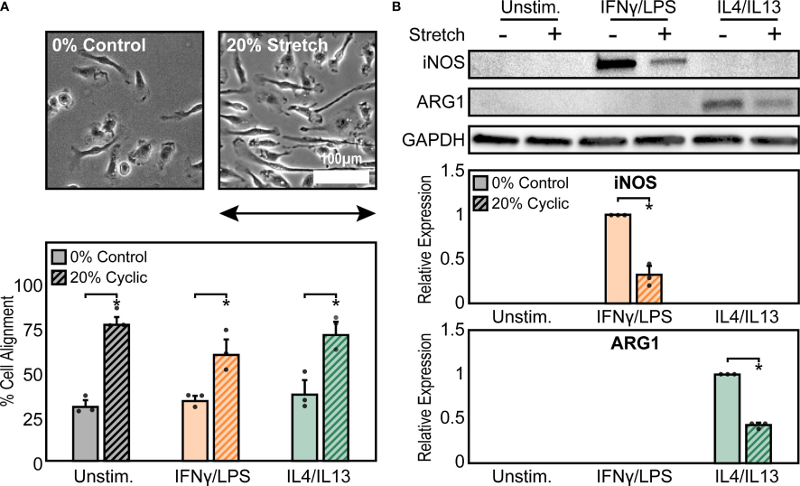
图1 机械拉伸会改变巨噬细胞的形态和活化。
在众多整合素亚型中,CD11b 或 αM整合素是巨噬细胞中含量最丰富的整合素,其表达通常用作巨噬细胞分化的标志物。实验在上述不同条件下测量了CD11b的表达,发现单独施加20%的静态拉伸或20%的循环拉伸未导致未刺激巨噬细胞中CD11b的表达差异(图2 A)。然而,IFNγ/LPS 刺激导致 CD11b 表达显著增加,并且在静态或循环拉伸后观察到进一步增加(图2 A)。IL4/IL13 刺激也增加了 CD11b 的表达,但拉伸降低了 IL4/IL13 诱导的 CD11b 表达,尤其在 20% 幅度的循环拉伸下(图2 A)。
接下来,为了更好地了解CD11b在拉伸机械转导中的作用,实验研究了暴露于CD11b siRNA(siCD11b)后巨噬细胞活化的变化,通过siCD11b 处理的细胞整合素表达降低证实CD11b 的敲低(图2 B)。此外,siCD11b 处理的细胞的炎性细胞因子分泌增强,尤其是 TNFα 和 IL6,而且消除了拉伸诱导的炎症抑制(图2 C)。相反,响应IFNγ/LPS和拉伸的炎症反应适度增强。相比之下,IL4/IL13 和 siCD11b 处理降低了 Arg1 的表达并阻止了任何拉伸诱导的变化,这表明 CD11b 在拉伸对愈合反应的影响中也起着重要作用(图2 D)。
作为调节CD11b表达的第二种方法,实验改变了拉伸前与底物的粘附时间,发现CD11b的表达取决于与底物的粘附时间,粘附时间越长,CD11b的表达量越高。这些数据表明,IFNγ/LPS 和拉伸处理可增强 CD11b 表达,从而降低炎症反应,而 IL4/IL13 和循环拉伸处理可抑制 CD11b 表达,从而降低愈合反应。
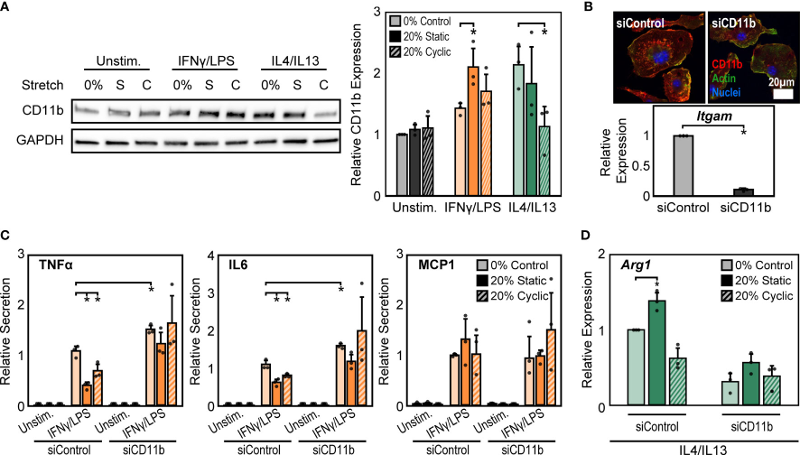
图2 CD11b是拉伸介导的巨噬细胞活化变化所必需的。
进一步地,为了评估 Piezo1 在调节拉伸介导的巨噬细胞炎症反应中的作用,实验检测了 Piezo1 的表达,并使用药理学和遗传学方法调节了 Piezo1 的活性或表达,发现IFNγ/LPS 处理导致 Piezo1 通道表达增强,且静态和循环拉伸均抑制IFNγ/LPS介导的通道表达(图3 A)。为了确定 Piezo1 表达降低在感应拉伸中的意义,接下来在 IFNγ/LPS 刺激和拉伸之前用 Piezo1 siRNA(siPiezo1)处理 BMDMs,发现siPiezo1处理的BMDMs无论拉伸如何,炎症反应都降低(图3 B)。此外,还评估了 Piezo1 激活后拉伸诱导的巨噬细胞炎症的变化,发现用Yoda1 激活Piezo1 后在对照和拉伸条件下都增强了 TNFα 的分泌,并阻止了拉伸介导的细胞因子产生的减少(图3 C)。这些数据表明,机械拉伸下调 Piezo1 表达,从而抑制 IFNγ/LPS 介导的炎症,并且 Yoda1 的添加可恢复 Piezo1 活性,从而增强炎症。
上述研究结果表明,拉伸会增加 CD11b 表达,同时降低 Piezo1 表达,这都会导致响应 IFNγ/LPS 的炎症减少。Piezo1 已被证明可以增强不同细胞类型中整合素的激活,因此接下来探索了 CD11b 和 Piezo1 在系统中的潜在联系。结果发现,用siCD11b处理的细胞的Piezo1表达增加(图3 D),相比之下,用 siPiezo1 处理的细胞的 Itgam、Itgb1、Itgb2 和 Itgb3 表达增加(图3 E)。这些数据表明,整合素和离子通道之间存在潜在的相互作用,其中一个的表达导致另一个的下调。此外,高 CD11b 和低 Piezo1 与对 IFNγ/LPS 的炎症反应降低有关,低 CD11b 和高 Piezo1 与较高的炎症有关。而且,拉伸诱导的这些表面蛋白表达的变化可能是与拉伸条件相关的炎症变化的原因。
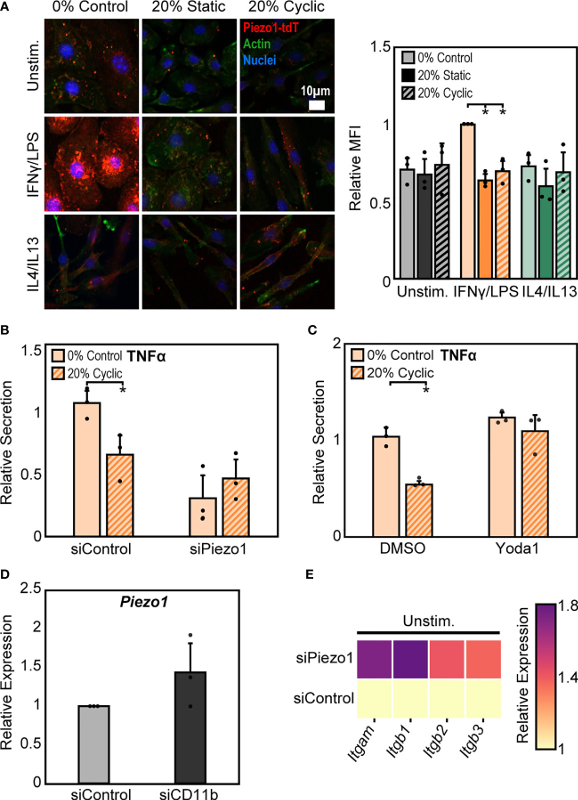
图3 Piezo1和CD11b之间的串扰介导巨噬细胞对拉伸的反应。
为了探究潜在的细胞内拉伸介质,实验最后研究了肌动蛋白的作用,肌动蛋白是一种与整合素相连的细胞骨架蛋白。结果观察到,与未刺激或 IL4/IL13 刺激的巨噬细胞相比,单独刺激会改变巨噬细胞中 F-肌动蛋白组成,IFNγ/LPS 刺激导致 F-肌动蛋白强度降低。在静态和循环拉伸之后,发现未刺激和 IFNγ/LPS 刺激的细胞中 F-肌动蛋白增强。相比之下,IL4/IL13 刺激的巨噬细胞中肌动蛋白适度增加(图4 A)。IFNγ/LPS 刺激的巨噬细胞中 F-肌动蛋白组成的这种差异调节反映了在拉伸介导的巨噬细胞中功能的变化,伴随与炎症水平的降低相关的肌动蛋白的减少。
为了确定CD11b在影响肌动蛋白中的作用,测量了siCD11b和siControl巨噬细胞中的F-肌动蛋白强度。结果发现,siCD11b 处理降低了 F-肌动蛋白强度(图4 B)。由于CD11b的缺失而导致的肌动蛋白变化可能表明这种整合素在建立细胞骨架完整性中的作用。为了进一步阐明肌动蛋白在拉伸转导中的作用,评估了暴露于肌动蛋白聚合抑制剂 CytoD后拉伸诱导的巨噬细胞活化的变化。结果发现,CytoD导致IFNγ/LPS诱导的TNFα分泌增强,但没有观察到拉伸介导的炎症减少(图4 C)。相比之下,CytoD 在所有条件下均抑制 IL4/IL13 诱导的 ARG1 表达(图4 D)。这些数据表明,肌动蛋白细胞骨架位于CD11b的下游,对于转导机械拉伸至关重要。
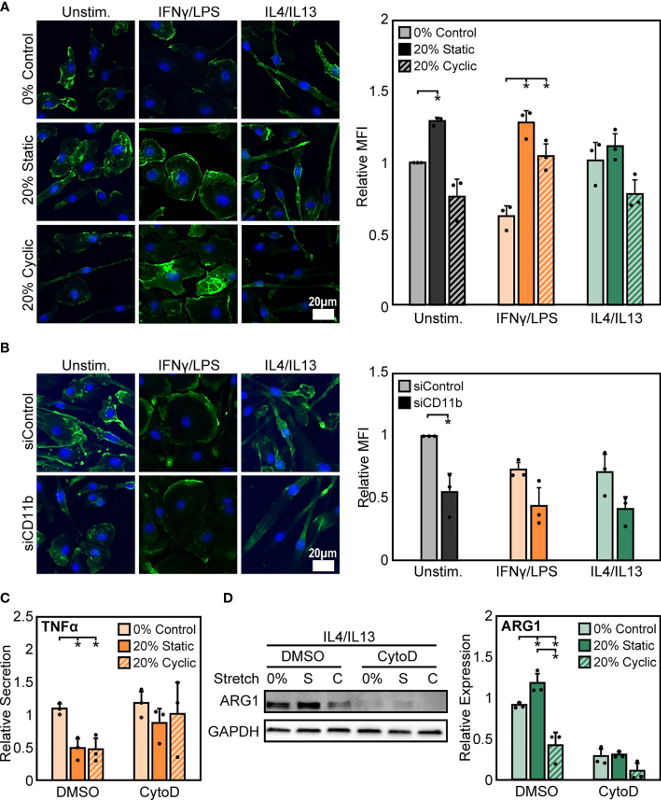
图4 拉伸引起的巨噬细胞活化变化需要肌动蛋白的调节。

表1 拉伸介导的巨噬细胞功能改变的综述。
总之,该研究描述了不同的机械拉伸幅度如何调节巨噬细胞功能,并为CD11b、Piezo1和肌动蛋白细胞骨架在转导机械刺激中的潜在作用提供了新的见解。虽然目前的研究仅限于在2D基质上培养的细胞中拉伸的影响,但未来的工作将考虑3D组织中的巨噬细胞,并受到多种机械力的影响,包括拉伸和流体剪切力或间质应力。需要进一步的研究来探索机械线索组合在代表生理组织的3D微环境中影响巨噬细胞的机制。这项工作可能会进一步理解机械力如何在体内平衡、伤口愈合以及炎症性疾病的进展过程中促进巨噬细胞行为。
参考文献:Atcha H, Meli VS, Davis CT, Brumm KT, Anis S, Chin J, Jiang K, Pathak MM, Liu WF. Crosstalk Between CD11b and Piezo1 Mediates Macrophage Responses to Mechanical Cues. Front Immunol. 2021 Sep 22;12:689397. doi: 10.3389/fimmu.2021.689397. PMID: 34630381; PMCID: PMC8493066.
原文链接:https://pubmed.ncbi.nlm.nih.gov/34630381/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
Naturethink牵张力|拉伸力|细胞拉伸|细胞牵张|细胞牵张应变|牵张应变细胞培养仪