周期性张应变通过移植静脉中的 circSlc8a1/miR-20a-5p 轴调节 Lamtor1 并促进内膜增生
冠状动脉旁路移植术(CABG)是冠心病心肌缺血的有效治疗手段之一,自体大隐静脉(SVG)移植仍是现今CABG中最常用的旁路血管。然而,越来越多的证据表明,由于静脉桥平滑肌细胞(SMCs)的异常增殖、迁移,导致血管不良重塑、新生内膜进行性增厚和再狭窄,严重影响了静脉桥的长期通畅率和静脉移植的失败。
据报道,生长因子和机械应力可以将静脉SMCs的表型从静止的收缩表型转变为高度增殖和合成的表型。研究表明,静脉移入动脉循环后,静脉SMCs会立即暴露于血管壁随动脉血压周期节律性变形引起的动脉周期性张应变下。尽管相关研究表明动脉机械拉伸在新内膜增生和静脉移植失败中起重要作用,但其分子机制仍远未完全了解。
Lamtor1(也称为p18)是一种特异定位于晚期内小体/溶酶体表面的膜蛋白,在溶酶体表面上激活雷帕霉素复合物1的哺乳动物靶标(mTORC1),并在随后调节细胞生长和稳态中发挥关键作用。mTOR信号被机械拉伸和初级纤毛激活,初级纤毛是一种重要的机械传感器。然而,mTORC1对机械刺激的反应机制尚不清楚,Lamtor1 是否具有机械反应性,调节 mTOR 信号的激活,以及它们在静脉移植后内膜增生中静脉 SMCs 的去分化和增殖中的机械生物学作用也未知。
在上海交通大学生命科学技术学院力学生物学研究所、上海交通大学医学院附属新华医院小儿外科、上海交通大学附属第六人民医院内分泌代谢科团队的一项研究中,采用体内“cuff”技术的静脉移植动物模型和体外应变加载系统,研究了动脉周期性张应变对Lamtor1表达和静脉SMC分化的影响。全转录组测序数据结合生物信息学分析提示circSlc8a1可能作为miR-20a-5p的海绵靶向Lamtor1。基于SMC特异性Lamtor1敲除(KO)小鼠,还进一步研究了Lamtor1和相关非编码RNA(ncRNAs)是否可以提供新的潜在治疗靶点,以防止内膜形成和静脉移植失败。具体内容发表在 Theranostics期刊题为“Arterial cyclic stretch regulates Lamtor1 and promotes neointimal hyperplasia via circSlc8a1/miR-20a-5p axis in vein grafts”。

首先,利用“cuff”技术构建小鼠静脉移植模型,模拟临床搭桥手术,并检测小鼠移植静脉中的新生内膜,发现移植1周后新生内膜明显增厚,增生面积明显增加。
为了确定Lamtor1在内膜形成中的作用,检查了静脉移植后Lamtor1的表达,发现移植静脉中的Lamtor1显著增加,且在新生内膜区表达急剧增加。增加的 Lamtor1 主要与 α-SMA 共定位,表明其在静脉 SMCs 中的细胞质表达。有趣的是,mTORC1的表达也上调。
之前揭示了内膜增生中静脉SMCs的异常增殖,在这里,通过Western blot分析了静脉SMCs的表型转化,这是增殖的基本步骤。结果表明,静脉移植物中α-SMA、钙调蛋白和SM22的表达均受到抑制。
这些数据表明,静脉移植到动脉循环后,Lamtor1 表达增加,并伴有 mTORC1 激活,以及静脉 SMCs 的去分化和增殖。这些过程可能参与静脉移植后的新内膜增生。
接下来,为了进一步了解静脉移植中 Lamtor1 调控的机制,对移植静脉和自体静脉对照进行了 RNA-seq。结果显示,有86个差异表达的miRNAs预测了与Lamtor1的结合位点,其中52个miRNAs在移植静脉中与自体对照组相比下调(图1 A)。
根据TargetScan数据库,miR-17-92簇和miR-29簇被预测参与Lamtor1的调控(图1 B),这两个miRNA簇与Lamtor1 3'-UTR结合的预测种子区域如图所示图1 B。然后进一步验证miR-17-92簇和miR-29簇的差异表达,结果表明,除miR-20b-5p外,移植静脉中miR-17-92簇和miR-29簇均被显著抑制(图1 C)。
RNA-seq还显示,移植静脉中有8个circRNAs上调,4个circRNAs下调(图1 D)。经过验证这些候选circRNAs的表达,circSlc8a1是移植静脉中上调最显著的(图1 E),并且是人、小鼠和大鼠中唯一保守的circRNA(图1 F)。因此,接下来的研究集中在circSlc8a1上。
FISH结果显示,阳性circSlc8a1染色和SMA阳性细胞均主要在体内新生内膜中表达(图1 G)。在培养的静脉SMCs中,circSlc8a1与细胞质中的α-SMA共定位(图1 H),这也表明了miR海绵的潜在作用。
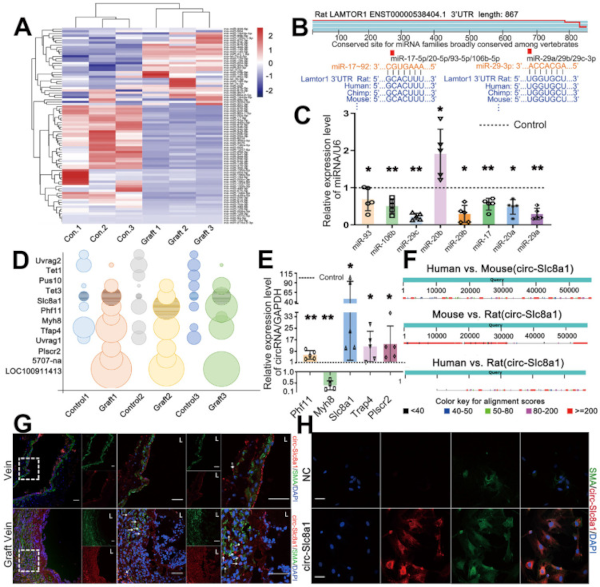
图1 CircSlc8a1 作为 miR-17-92 的海绵,促进了 Lamtor1 的表达。
然后通过特异性敲低circSlc8a1的表达研究其在静脉SMCs增殖和去分化中的作用。结果显示,敲低circSlc8a1可降低静脉SMCs的增殖,静脉SMC分化标志物α-SMA、钙调蛋白和SM22的表达显著升高,且circSlc8a1 的下调也抑制了 Lamtor1 的表达。
进一步确定与circSlc8a1结合的潜在miRNAs,发现circSlc8a1和miR-20a-5p在Ago2沉淀的复合物中显著富集。Western blot分析表明,circSlc8a1敲低抑制Lamtor1表达并促进静脉SMC分化,而同时转染miR-20a-5p可逆转这些作用。此外,miR-20a-5p沉默消除了circSlc8a1对Lamtor1蛋白表达的抑制作用。circSlca81特异性siRNA抑制SMCs增殖,而miR-20a-5p抑制消除了circSlc8a阻断的抑制作用。
此外,实验还确定了 Lamtor1 的效应子 mTORC1 是否有助于静脉 SMC 去分化。雷帕霉素(mTORC1特异性抑制剂,可诱导静脉SMC分化)和Lamtor 1特异性siRNA增加了收缩标志物的表达,包括α-SMA、钙调蛋白和SM22,并抑制了增殖。为了验证 Lamtor1 或 cirSlc8a1 是否通过 mTORC1 参与 SMC 去分化,用亮氨酸激活 mTORC1,结果显示,在mTORC1激活过程中,α-SMA、钙调蛋白和SM1等收缩标志物的表达降低,而同时敲低Lamtor1或circSlc8a1的表达可增加α-SMA、钙调蛋白和SM22的表达。
这些结果验证了circSlc8a1和miR-20a-5p在静脉SMCs中的直接相互作用,表明circSlc8a1作为miR-20a-5p海绵,正向调控静脉SMCs中Lamtor1的表达。
进一步地,实验研究了体外机械周期性应变(10%,1.25 Hz,6h,10h,24h)是否调节了静脉SMCs中circSlc8a1/miR-20a-5p/Lamtor1的表达(图2 A)。
与静态对照相比,10% 周期性张应变显著提高了circSlc8a1的表达(图2 B),但在6h并持续到24h时降低了miR-20a-5p表达(图2 C)。进一步检测Lamtor1的表达和mTORC1信号的活性,发现周期性张应变在6h和12h点显著上调Lamtor1表达(图2 D),并刺激mTORC1、4EBP1和p70S6K的磷酸化(图2E)。
然后检测 Lamtor1 是否参与了周期性张应变对静脉 SMC 的去分化和增殖,发现与静态对照相比,应变诱导的BrdU掺入量为1.7倍(图2 F),并降低静脉SMC收缩标志物的表达(图2 G)。而Lamtor1 siRNA逆转了机械应变对静脉SMC增殖的影响(图2 F)和去分化(图2 G、H)。
此外,还检测了应变是否通过circSlc1a8调节Lamtor1的表达并促进静脉增殖和去分化。通过敲低circSlc8a1,可以逆转机械应变诱导的增殖增加(图2 I)和收缩标记物表达的减少(图2 J)。同时,circSlc8a1敲低逆转了机械应变诱导的静脉SMC中Lamtor1表达的增加(图2 J)。
这些结果表明,动脉机械张应变诱导circSlc8a1和随后的Lamtor1的表达,参与静脉SMCs的去分化和增殖,并可能参与了静脉移植过程中的血管重塑。
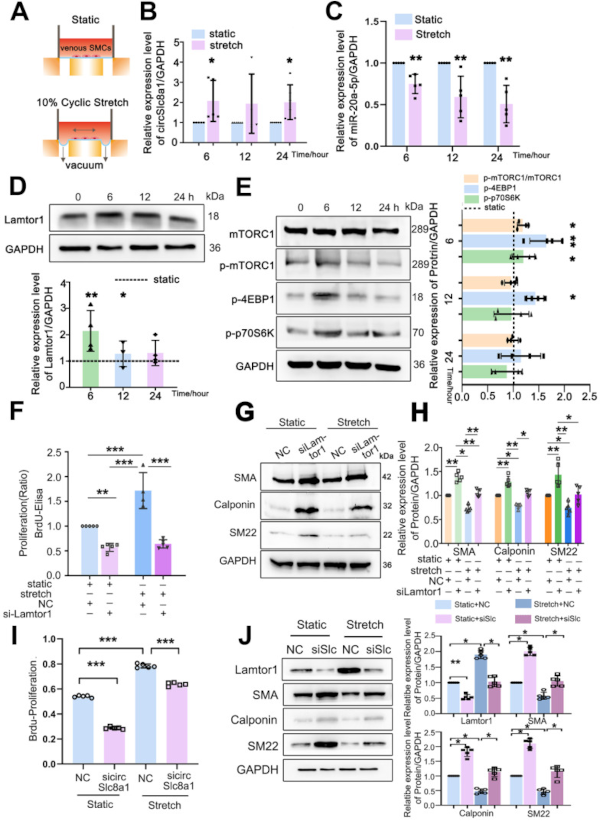
图2 动脉机械拉伸上调 circSlc8a1 和 Lamtor1。
最后,实验试图确定circSlc8a1在体内新生内膜形成中的潜在作用,发现CircSlc8a1敲低可显著减弱移植静脉中新生内膜的形成。Western blot和免疫染色结果显示,circSlc1a8敲低组移植静脉中Lamtor1蛋白水平降低,mTORC1和底物(包括p70S6K和4EBP1)的磷酸化也显著减弱,并促进静脉SMC的分化。
然后接着评估了 Lamtor1 在移植静脉新生内膜形成中的作用。通过生成 SMC 特异性 Lamtor1 KO 小鼠,发现小鼠静脉介质层中Lamtor1的表达被消除(图3 A、C),在1周静脉移植物中显示出内膜面积和内膜与中膜比率的显著降低(图3 B)。然后研究了 SMCs 中 Lamtor1 的特异性缺失是否抑制了体内 mTORC1 的活性。免疫染色显示,小鼠中移植静脉的p70S6K磷酸化显著降低(图3 D),收缩蛋白的表达升高(图3 E)。
这些数据表明,体内 SMCs 中 Lamtor1 的特异性 KO 减弱了 mTORC1 信号的激活和静脉 SMC 的去分化,这也有助于搭桥手术后新生内膜的形成。
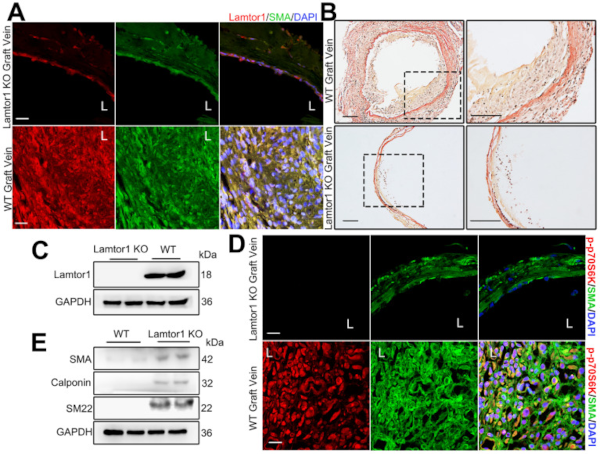
图3 SMC 中 Lamtor1 的消除减弱了静脉移植手术诱导的新内膜形成。
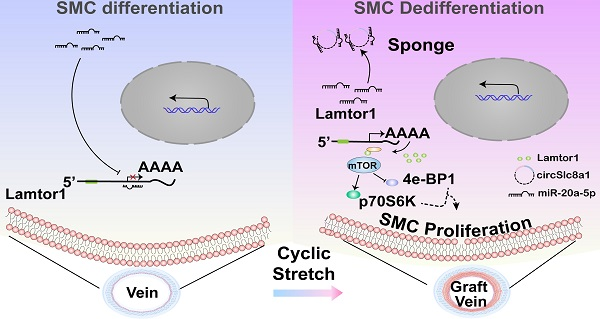
图4 图形概要
总之,该研究表明,Lamtor1 通过激活 mTORC1 信号通路并诱导静脉 SMCs 的去分化和增殖来诱导静脉移植后新生内膜增生。CircSlc8a1 响应动脉周期性张应变,充当 miR-20a-5p 的海绵,随后调节 Lamtor1 的表达。敲低 Lamtor1 或 circSlc8a1 可减轻静脉移植中的内膜增生。因此,包括circSlc8a1和Lamtor1在内的这些机械反应分子可能为人自体静脉移植手术后的内膜增生提供潜在的治疗靶点。尽管基于高度的同源性和保守性,体内和体外动物模型研究为CABG术后内膜形成的诊断和治疗提供了重要建议,但circSlc8a1/miR-20a-5p轴的临床实验在进一步的研究中仍然至关重要。
参考文献:Liu JT, Yao QP, Chen Y, Lv F, Liu Z, Bao H, Han Y, Zhang ML, Jiang ZL, Qi YX. Arterial cyclic stretch regulates Lamtor1 and promotes neointimal hyperplasia via circSlc8a1/miR-20a-5p axis in vein grafts. Theranostics. 2022 Jun 21;12(11):4851-4865. doi: 10.7150/thno.69551. PMID: 35836818; PMCID: PMC9274756.
原文链接:https://pubmed.ncbi.nlm.nih.gov/35836818/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.Naturethink.com/
Naturethink牵张力|拉伸力|细胞拉伸|细胞牵张|细胞牵张应变|牵张应变细胞培养仪
http://www.Naturethink.com/?product/19.html