辛伐他汀的局部给药通过抗炎特性和 AMPK/MAPK/NF-kB 抑制在机械性牙齿移动过程中维持牙齿锚固
牙颌面畸形给患者带来了很多身心困扰。正畸牙齿移动(OTM)是解决此问题的主要策略,通过应用固定的或可移动的机械性手段来调整牙齿排列,这涉及牙槽骨和支撑牙周组织的生物力学适应。引入生物疗法来辅助这种机械诱导的物理运动,通过加快局部移动速度或精确增加牙槽中的牙齿锚定,来缩短治疗周期并减少患者因疼痛和不适引起的不依从性,引起了研究人员极大的关注。现有的生物疗法包括化学方法(细胞因子、激素、药物、生长因子和其他生物物质)和基因疗法,其中最有潜力的转化方法是局部给药。
辛伐他汀(SMV)作为 HMG-CoA 还原酶抑制剂,是一种降胆固醇的他汀类药物。根据临床试验观察,SMV的摄入有利于慢性牙周炎的控制,因为它具有限制炎症和修复牙周组织的功能。动物研究表明,全身施用 SMV 可增加牙齿锚固并减少牙根吸收。因此,有可能假设 SMV 在生物力学诱导的炎症条件下对牙周组织具有骨合成代谢特性。
腺苷酸活化蛋白激酶(AMPK)是丝/苏氨酸蛋白激酶,主要协调代谢和能量的需要。最近,研究人员发现了它在诱导自噬、炎症控制、肿瘤转移和自身免疫抑制中的作用。此外,还发现AMPK-α1敲除(AMPK-α1-/-)小鼠表现出比野生型(WT)小鼠更大的炎性牙周骨缺损,并表达更高水平的炎性细胞因子。有趣的是,OTM是一个生物力学过程,伴随着张力侧骨再生和压力侧骨吸收,这表明在生物力学刺激下,AMPK在炎症介导的成骨过程中激活。
目前的体外观察基于静态培养牙周膜细胞(PDLCs),这导致 PDLCs 在 OTM 期间的实际应力状态存在很大不一致。在华中科技大学同济医学院附属同济医院口腔科、宁夏医科大学总医院口腔颌面外科及美国奥古斯塔大学牙科学院口腔生物学和诊断科学系课题组的一项联合研究中,采用体外动态张力拉伸培养系统模拟OTM中的应力条件,重点关注了 SMV 在啮齿动物模型中对正畸移动牙齿张力侧的抗炎作用,并探索了AMPK调控的潜在机制。研究成果发表在 The Journal of Cellular and Molecular Medicine 期刊题为“Local delivery of simvastatin maintains tooth anchorage during mechanical tooth moving via anti-inflammation property and AMPK/MAPK/NF-kB inhibition”。

通过应用体外张力系统加载外部机械刺激,将PDLCs用 10% 等双轴应变以 0.1Hz 拉伸24小时,然后分为六组:
1. C-CON:无张力和无 SMV;
2. C-SMV:无张力+0.05UM SMV;
3. T-CON:仅张力;
4. T-SMV:张力+0.05UM SMV;
5. T-Compound C:张力+0.05UM SMV+1UM Compound C(AMPK抑制剂);
6. T-AICAR:张力+0.05UM SMV+1UM Compound C+1MM AICAR(AMPK激活剂)。
首先,通过比较PDLCs在药物浓度梯度增加下的增殖率,实验确定了用于体外测试的适当SMV浓度,基因表达水平的变化表明,0.05UM SMV诱导PDLCs的成骨和血管生成分化最强,因此选择0.05UM SMV进行后续实验。
SMV 具有保护性骨合成代谢和抗骨吸收特性,接下来实验专注于确定负责 SMV 在增加牙齿锚固方面的治疗效果的内在因素。通过利用蛋白质阵列技术,扫描了张力和 SMV-致敏的共刺激的PDLCs 中 20 种促炎因子和抗炎因子,发现IL-6是PDLCs在共刺激下诱导的最显著的细胞因子。为了检测AMPK在SMV诱导的抗炎过程中的潜在作用,随后测量了细胞中p-AMPK/AMPK和p-P65/P65(NF-κB)的表达水平,数据表明,AMPK的增加与IL-6的分泌呈负相关。
通过给药 AMPK 抑制剂Compound C 和 AMPK 激活剂 AICAR 来分析 AMPK 信号传导的干预。RUNX2、BMP-2 和 VEGF 是成骨过程中的重要因素。与静态培养相比,机械张力显著增加了BMP-2和VEGF的表达,RUNX2表达没有明显的增强。然而,SMV的加入显著提高了三个成骨相关基因的表达水平(图1 A-C)。SMV给药在静态环境下增加促炎因子的表达,但在张力刺激下,这种变化被逆转,Compound C和AICAR的预处理进一步证明了这一趋势(图1 D)。抑制AMPK在所有时间点均显著升高NF-κB表达,但在加入AICAR后,这种变化被逆转。然而,张力培养条件对RUNX2表达没有统计学影响(图1 E),却显著增加了AMPK的表达,SMV给药在6h和12h 时协同提高了其表达水平,但Compound C 可以抑制这种变化(图1 F)。这些结果表明,SMV通过抗炎作用促进OTM期间牙周组织张力侧的成骨。

图1 诱导 6 小时、12 小时和 1 天后的实时荧光定量 PCR 检测。
(A)RUNX2的折叠表达。(B)BMP-2的折叠表达。(C)VEGF的折叠表达。(D)TNF-ɑ的折叠表达。(E)NF-κB的折叠表达。(F)AMPK的折叠表达。
接下来,为了进一步阐明AMPK在张力条件下对SMV刺激的PDLCs的影响,实验通过Western blot检测了MAPK/NF-κB信号(图2 A)。结果显示,0.05UM SMV处理下调了p-ERK、p-P38和p-P65的折叠表达(图2 B),但这种变化会被Compound C 改变,并进一步被AICAR恢复,这与p-AMPK水平呈负相关。然后通过ELISA检测了处理的上清液中TNF-α和IL-1的表达,发现张力和SMV共同刺激下TNF-α和IL-1的分泌量与NF-κB p65磷酸化水平表现出相似的变化模式(图2 C)。这说明,SMV降低了炎症因子水平。 SMV 通过抑制 AMPK/MAPK/NF-ΚB 促进 OTM 期间牙周组织张力侧的成骨。
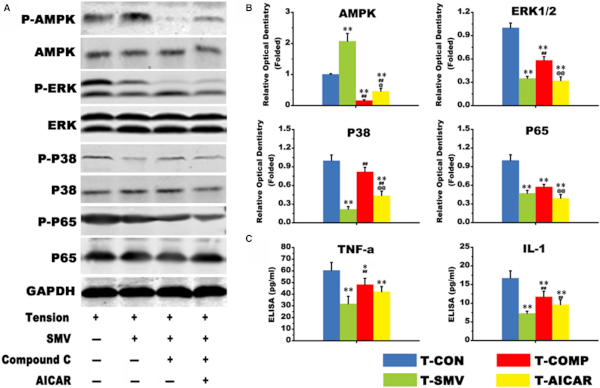
图2 蛋白质印迹分析。
(A)AMPK、ERK1/2、P38、P65的蛋白表达及其磷酸化水平。(B)p-AMPK/AMPK,p-ERK/ERK,p-P38/P38 和 p-P65/P65 的相对牙科光学。
最后,研究人员对实验小鼠分别进行了手术观察、显微CT评估和组织学观察。实验中共有24只 SD 大鼠接受了正畸矫治器放置。在7天的预处理期间,所有大鼠总体健康状况良好,然后加载机械刺激,观察到炎症反应有限的部位。
然后进行显微CT评估,对照组上颌第一磨牙远端根部周围出现大量骨吸收,SMV组远端根部周围骨骼高度基本维持在分叉位置。对照组上颌第一磨牙移动距离显著高于SMV组和AICAR组。对照组与Compound C 组差异无统计学意义。此外,BV/TV百分比在对照组最低,SMV组最高,而Compound C处理使BV/TV降低,AICAR处理使其又显著提高。
组织学观察的H&E染色显示牙周组织压力侧比张力侧窄(图3 A)。观察远端牙根张力侧(黄色方块内)的牙周膜,发现对照组牙周膜厚度较大,排列更混乱,细胞核明显长于其他三组。同时,SMV组牙周间隙的变化受到限制。其他三组张力侧均未见明显骨吸收部位,如黄色箭头所示。在SMV组中检测到少量的炎症细胞的流入。Compound C组和AICAR组的组织学检查结果介于前两组之间。在细胞排列方面,Compound C组与对照组更相似。细胞核数的组织形态学评估证明了这一趋势(图3 B)。具体而言,对照组的细胞数量多于SMV组、Compound C组和AICAR组。
免疫组织学染色显示,对照组移动磨牙张力侧NF-κB和TNF-α表达呈强阳性。这两个因子在SMV组中表达最弱,然而,在Compound C 组的牙周膜中可以看到它们均匀分散着色;两个因子的染色细胞百分比在四组间的变化相同,这与H&E染色的组织形态学结果相似(图3 C、D)。此外,在对照组中观察到多个红色染色的破骨细胞,但在SMV组和AICAR 组中几乎没有检测到具有红色破骨细胞的特征性骨吸收坑以及再吸收的骨表面。与对照组、Compound C 组和AICAR组相比,SMV组的Howship's lacunae(豪希普氏腔隙)数量较低。对照组与AICAR组差异均有统计学意义(图3 E)。在细胞大小和细胞数量方面,对照组明显大于其他3组(图3 F)。

图3 组织学和组织形态学检查结果。
(A)H&E染色、NF-κB和TNF-ɑ免疫组织学染色,4组的Trap染色。(B)细胞核数。(C)NF-κB阳性细胞评估。(D)TNF-ɑ阳性细胞评估。(E)Howship's lacunae数。(F)Trap染色细胞的阳性细胞。
总之,该研究表明,SMV 可以通过抑制 AMPK/MAPK/NF-kB 来促进 PDLCs 中 AMPK 的内在激活,从而减轻在拉伸刺激下发生的炎症。然而,该研究主要讨论了张力刺激,不能代表牙齿在正畸力下的整体应力状态。此外,对机械性骨形成机制的完整理解需要对破骨细胞及其反应进行识别和分析。该研究确认了AMPK/MAKP/NF-κB 通路的抑制介导 SMV 骨保护作用对 OTM 期间牙齿锚固的增强作用。
参考文献:Xu L, Sun X, Zhu G, Mao J, Baban B, Qin X. Local delivery of simvastatin maintains tooth anchorage during mechanical tooth moving via anti-inflammation property and AMPK/MAPK/NF-kB inhibition. J Cell Mol Med. 2021 Jan;25(1):333-344. doi: 10.1111/jcmm.16058. Epub 2020 Dec 12. PMID: 33314684; PMCID: PMC7810950.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33314684/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.Naturethink.com/
Naturethink牵张力|拉伸力|细胞拉伸|细胞牵张|细胞牵张应变|牵张应变细胞培养仪
http://www.Naturethink.com/?product/19.html