肿瘤相关巨噬细胞与肿瘤细胞之间的串扰通过CXCL5/PI3K/AKT/mTOR通路促进胃癌的化疗抵抗
胃癌是最普遍的恶性肿瘤之一,是全球癌症相关死亡的第二大原因。尽管手术前后联合化疗已被证明可以提高患者的生存率,但化疗抵抗(chemoresistance)的发生仍然是获得有效化疗的主要障碍。5-FU(五氟尿嘧啶)仍然是胃癌的一线化疗药物,但化疗抵抗往往出现导致临床结果不理想。因此,更好地了解5-FU耐药的分子机制对于改善胃癌的临床结果至关重要。
研究表明,肿瘤细胞与肿瘤微环境(TME)其他成分之间的串扰促进了化疗抵抗的发展。肿瘤相关巨噬细胞(TAMs)构成TME中的主要免疫细胞,TAMs分泌多种细胞因子和趋化因子进入TME,这些小蛋白是重要的调节剂,可以促进治疗耐药性的发展。TAMs分泌的CCL2被揭示可激活乳腺癌细胞中的PI3K/AKT/mTOR通路,从而诱导乳腺癌对他莫昔芬治疗的耐药性。TAMs通过EMT程序调节5-FU介导的结直肠癌化疗耐药性,并通过释放CCL22调节caspase-介导的细胞凋亡。基于上述研究现状,可以推测TAMs分泌的细胞因子或趋化因子可能促进胃癌化疗抵抗的发展。
基于此,北京协和医院普通外科、病理科课题组的一项研究曾探讨了TAMs与胃癌细胞化疗抵抗表型之间的相互作用。实验首先研究了CD68(TAMs标志物)在接受基于5-FU的新辅助化疗的胃癌患者胃癌组织中的临床价值,并阐明了TAMs浸润与胃癌对化疗抵抗之间的相关性,此外还鉴定了一种特异性趋化因子CXCL5并进一步研究了其潜在的分子机制与疾病预后的相关性。该研究结果揭示了TAMs与胃癌细胞之间的相互作用,提高了对TAMs如何促进胃癌化疗抵抗的认识,并可能为化疗抵抗性胃癌患者提供一种新的治疗策略。相关内容发表在 Cancer Cell International 期刊题为“Crosstalk between tumor-associated macrophages and tumor cells promotes chemoresistance via CXCL5/PI3K/AKT/mTOR pathway in gastric cancer”。

首先,为了研究巨噬细胞在胃癌中的生物分布,实验通过免疫组化检测了接受 5-FU 新辅助化疗患者临床样本中巨噬细胞标志物之一 CD68 的表达。结果显示,与病理组相比,无病理反应组组织中浸润的巨噬细胞数量显著增加。这表明,巨噬细胞浸润可能在胃癌化疗抵抗的发生和发展中起关键作用。
然后通过将亲本细胞连续暴露于浓度递增的 5-FU 来建立两种 5-FU-抵抗性胃细胞系 MKN45-R 和 HGC27-R。CCK-8 测定证实了5-FU以剂量依赖性方式降低细胞活力。此外,化疗抵抗性相关蛋白P-gp和抗凋亡蛋白Bcl-2显著升高,促凋亡蛋白Bax显著降低。这些数据表明,细胞通过长期 5-FU 的诱导获得化学抵抗性。
接着将人单核细胞系THP-1分化为巨噬细胞(M0),随后分别与MKN45-R、HGC27-R细胞及其亲本细胞以非接触式共培养48小时,获得来自5-FU-敏感性TME(MS)和5-FU抵抗性TME(MR)的TAMs(图1 A),采用RT-qPCR分析共培养胃细胞对M0细胞的影响。结果显示,MS和MR细胞中CD86、TNF-α和IL-12等M1相关基因表达水平相对于M0细胞下调,且MR细胞的表达水平显著低于MS细胞(图1 B、C)。相比之下,CD163、CD206、IL-10、Arg-1和VEGF-A等M2相关基因表达水平上调,且MR细胞的表达水平明显高于MS细胞(图1 B、C)。此外,流式细胞术分析结果显示,MS和MR细胞中M1巨噬细胞的百分比降低,M2巨噬细胞百分比增加(图1 D)。这些结果表明,胃癌细胞可以调节巨噬细胞向M2样极化,而化疗抵抗细胞似乎更有效地诱导巨噬细胞极化为M2表型。
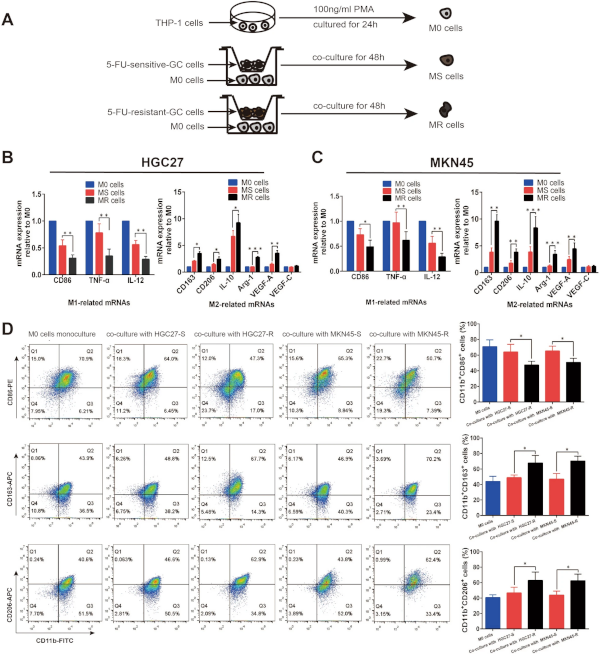
图1 共培养的胃癌细胞诱导巨噬细胞极化为 M2 表型。
接下来,将胃癌细胞与不同表型的巨噬细胞在非接触式共培养系统中培养48小时,然后清除巨噬细胞并收集胃癌细胞进行进一步分析(图2 A),采用CCK-8法检测巨噬细胞对5-FU耐药性的影响。结果表明,与MS和MR巨噬细胞共培养使HGC27-S细胞和MKN45-S 细胞的IC50值均增强(图2 B、C)。此外,共培养MR巨噬细胞显著促进胃癌细胞对5-FU的抵抗性,而MS巨噬细胞的作用明显小于MR巨噬细胞(图2 D、E)。
然后通过流式细胞术检测化疗诱导的细胞凋亡。结果表明,与单独培养或与MS巨噬细胞共培养的胃癌细胞相比,与MR巨噬细胞共培养的胃癌细胞的凋亡率显著降低(图2 F、G)。Western blot分析进一步表明,在与MR巨噬细胞共培养的胃癌细胞中,P-gp和Bcl-2的表达水平显著升高,Bax显著降低(图2 H、I)。这些结果表明,5-FU-抵抗性胃癌细胞可以有效地诱导巨噬细胞极化为M2表型,这反过来又促进胃癌细胞的5-FU-抵抗性。
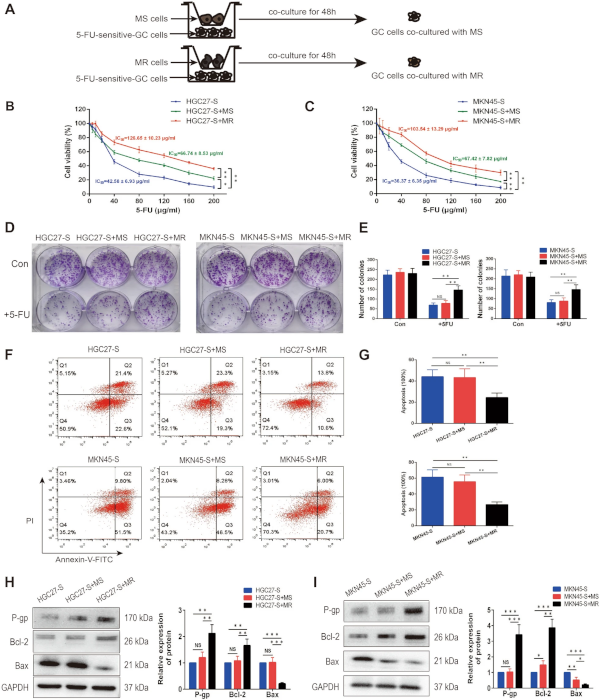
图2 共培养M2极化的巨噬细胞增强胃癌细胞5- Fu抵抗性。
进一步地,研究人员推测MS和MR巨噬细胞增强胃癌细胞5-FU抵抗能力的不同可能是由于分泌的细胞因子水平不同,因此选取11种细胞因子进行了RT-qPCR分析,发现只有CCL18和CXCL5的转录水平与以往结果的趋势一致。与CCL18相比,MS和MR巨噬细胞中的CXCL5水平非常高,因此重点关注CXCL5,以验证其在胃癌细胞5-FU耐药中的作用。将5-FU-敏感性胃癌细胞在存在rhCXCL5或CXCL5中和抗体下单独培养或与MR巨噬细胞共培养48小时,然后用不同浓度的5-FU处理24小时评估细胞存活率。CCK-8实验所示,共培养MR巨噬细胞或添加rhCXCL5可诱导5-FU耐药,而CXCL5中和抗体可降低胃癌细胞中MR巨噬细胞介导的对5-FU的耐药性。上述结果表明,来源于M2极化巨噬细胞的CXCL5是胃癌细胞中与5-FU抵抗性相关的主要趋化因子之一。
越来越多的证据表明,对细胞凋亡的抵抗是导致化疗抵抗的原因。5-FU主要通过介导肿瘤细胞凋亡来发挥抗肿瘤作用。因此,实验想要确定 M2 极化巨噬细胞是否通过调节胃癌细胞凋亡介导 5-FU-抵抗性。结果表明,共培养MR巨噬细胞或rhCXCL5都可以降低凋亡比例,然而应用CXCL5中和抗体会降低MR巨噬细胞介导的胃癌细胞凋亡抵抗力(图3 A、B)。Western blot分析进一步表明,共培养MR巨噬细胞或添加rhCXCL5可增加Bcl-2的表达,降低Bax的表达,而CXCL5中和抗体可显著减弱这种效应(图3 C、D)。既往研究表明,PI3K/AKT/mTOR信号通路通过调节细胞增殖、凋亡和化疗抵抗在肿瘤进展中起关键作用。基于此,进一步研究了M2极化巨噬细胞对PI3K/AKT/mTOR通路激活的潜在影响,发现共培养MR巨噬细胞和rhCXCL5均能显著提高磷酸化的PI3K、AKT和mTOR的表达,而CXCL5中和抗体处理显著减弱这种激活该信号通路的能力。这些数据表明,M2极化巨噬细胞来源的CXCL5可抑制细胞凋亡,激活PI3K/AKT/mTOR通路,增加胃癌细胞5-FU-抵抗性。

图3 M2极化的巨噬细胞通过激活胃癌细胞CXCL5/PI3K/AKT/mTOR通路抑制细胞凋亡,增加5-Fu耐药性。
最后,为了确定巨噬细胞如何影响胃癌中单核细胞的募集,进行了趋化性测定,发现MR巨噬细胞的趋化诱导作用明显强于M0和MS巨噬细胞,CXCL5中和抗体可减弱MR巨噬细胞诱导的胃癌趋化作用。采用免疫组化法检测患者临床标本中CXCL5、CD163和CD206的表达,观察到CXCL5的高表达与CD163阳性巨噬细胞和CD206阳性巨噬细胞的高浸润相关。基于上述数据,可以推测胃癌细胞,尤其是化疗抵抗细胞可以诱导巨噬细胞极化为 M2 表型,从而导致 CXCL5 分泌增加。高水平的CXCL5可以反过来募集单核细胞形成更多的M2极化巨噬细胞,进一步促进胃癌化疗抵抗微环境的发展。
然后通过免疫组化法检测患者临床样本中CXCL5的表达水平分析CXCL5在胃癌患者预后的临床相关性。CXCL5低表达和高表达的代表性图像如图4所示。此外,CXCL5高表达患者的总生存率(OS)显著低于CXCL5低表达患者(图4 B)。上述结果表明,CXCL5可作为预测胃癌化疗抵抗和预后的有效生物标志物。

图4 CXCL5在胃癌组织中的高表达与患者的不良预后相关。(C)显示巨噬细胞如何与胃癌细胞相互作用以促进胃癌化疗抵抗微环境发展的图形摘要。
综上所述,该研究发现化疗抵抗的胃癌细胞更有效地诱导巨噬细胞极化为M2表型,进而反过来促进胃癌细胞的化疗抵抗性,从而在TAMs和胃癌细胞之间形成正反馈回路(图4 C)。TAMs衍生的CXCL5在细胞间相互作用中起着关键作用。CXCL5可以募集单核细胞形成更多的M2极化巨噬细胞,并通过激活胃癌PI3K/AKT/mTOR通路进一步促进化疗抵抗的发展。这些发现表明,靶向TAMs并阻断TAMs与胃癌细胞之间的细胞间串扰可能代表了化疗抵抗性胃癌患者的潜在治疗策略。
参考文献:Su P, Jiang L, Zhang Y, Yu T, Kang W, Liu Y, Yu J. Crosstalk between tumor-associated macrophages and tumor cells promotes chemoresistance via CXCL5/PI3K/AKT/mTOR pathway in gastric cancer. Cancer Cell Int. 2022 Sep 23;22(1):290. doi: 10.1186/s12935-022-02717-5. PMID: 36151545; PMCID: PMC9508748.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36151545/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.naturethink.com/
Naturethink多细胞培养|共培养体系|共培养模型|共培养实验|动态细胞共培养|仿血流多细胞动态共培养系统
http://www.naturethink.com/?product/81.html