通过机械、渗透或药物刺激激活 TRPV4 可抗炎阻断 IL-1β 介导的关节软骨基质破坏
骨关节炎(OA)是最常见的慢性关节疾病。软骨的健康是通过对机械刺激的响应来维持的,压缩或拉伸应变形式的机械负荷在软骨细胞中具有抗炎作用,并阻断促炎介质一氧化氮(NO)和前列腺素E2(PGE2)的释放,以响应白细胞介素-1β(IL-1β)。炎症信号传导导致OA中的软骨退化,因此了解机械负荷与炎症之间的联系会对治疗产生重大的影响。
瞬时感受器电位离子通道香草素受体4(TRPV4)是一种Ca²⁺可渗透的非选择性阳离子通道,在关节软骨细胞中高度表达,并被机械刺激激活。TRPV4 是软骨细胞和其他细胞类型机械转导所必需的,它介导促合成代谢和抗分解代谢基因的调控,促进软骨中细胞的增殖和基质的产生,而这两者都会影响关节的生长。TRPV4 定位于质膜和初级纤毛。初级纤毛参与了软骨细胞机械传导和炎症信号传导。研究已经报道了机械负荷通过与鞭毛内运输(IFT)/纤毛改变相关的组蛋白脱乙酰基酶6(HDAC6)激活与来抵消炎症信号,以响应促炎细胞因子白细胞介素1β(IL-1β)。TRPV4 在该途径中的作用尚未确定。
基于此,在英国伦敦玛丽女王大学工程与材料科学学院研究团队的一项实验中,首次证明了通过循环拉伸应变(CTS)、低渗透刺激或 TRPV4 选择性激活剂GSK1016790A 激活 TRPV4 可抑制促炎性 IL-1β 信号传导和与初级纤毛伸长改变相关的软骨降解。因此,TRPV4 可能为治疗关节疾病和其他炎症病变提供新的靶点。相关内容发表在Osteoarthritis AND Cartilage 期刊题为“Activation of TRPV4 by mechanical, osmotic or pharmaceutical stimulation is anti-inflammatory blocking IL-1β mediated articular cartilage matrix destruction”。

首先,IL-1β 处理(1-10 ng/ml浓度,24h)导致 NO 和 PGE2 的显著剂量依赖性释放,而CTS(0.33 Hz,0-10% 应变,24 h)形式的机械载荷显著降低了这种反应。IL-1β诱导的NO释放被CTS消除,因此1或10 ng/ml均无统计学意义,CTS在1 ng/ml IL-1β浓度下完全抑制PGE2的释放,但在10 ng/ml浓度下仅部分抑制PGE2的释放。用TRPV4拮抗剂GSK205(10μM)同时处理可消除机械负荷的抗炎作用。此外,GSK205 在有或没有 IL-1β 的无负载细胞中对 NO 或 PGE2 释放没有影响,但在有 IL-1β 的负载细胞中 IL-1β 效应可被恢复,NO 和PGE2 释放均被IL-1β显著提高。无论是否存在 CTS,IL-1β 和 GSK205 处理均不影响 TRPV4 蛋白水平。这些数据表明,机械负荷的抗炎作用是由 TRPV4 激活介导的。
接下来,实验将分离的软骨细胞用高渗透压培养基(400 mOsm)、低渗透压培养基(200 mOsm)或等渗透压培养基(315 mOsm)处理24小时(图1 A、B)。结果表明,无论是否存在IL-1β ,与等渗对照相比,高渗透刺激对NO释放没有显著影响,而低渗透刺激显著减弱了IL-1β(1 ng/ml)的促炎反应,使得24 h时NO释放的增加显著降低(图1 A),但对细胞活力没有明显影响(图1 B)。在GSK205存在下,完全抑制了低渗透刺激对IL-1β诱导的NO释放的抗炎作用,使得NO释放的效果与对照条件没有显著差异(图1 A)。
在软骨外植体中,低渗透刺激显著降低了 IL-1β 诱导的 NO 释放(图1 C),而且阻断了IL-1β介导的sGAG释放,表明细胞外基质降解减少。在整个实验过程中,软骨细胞活力保持不变(图1 D)。与分离的细胞一致,在存在或不存在 1 ng/ml IL-1β 的情况下,高渗透刺激对 NO 或 sGAG 释放没有影响。GSK205 处理恢复了低渗透介质中 IL-1β 诱导的 NO 释放从而阻断渗透激发的抗炎作用(图1 C)。有趣的是,GSK205 进一步增加了 IL-1β 诱导的 NO 在等渗对照培养基中的释放,这在分离细胞中未见(图1 C)。这些数据共同表明,低渗透压负荷的抗炎作用也是由 TRPV4 激活介导的。
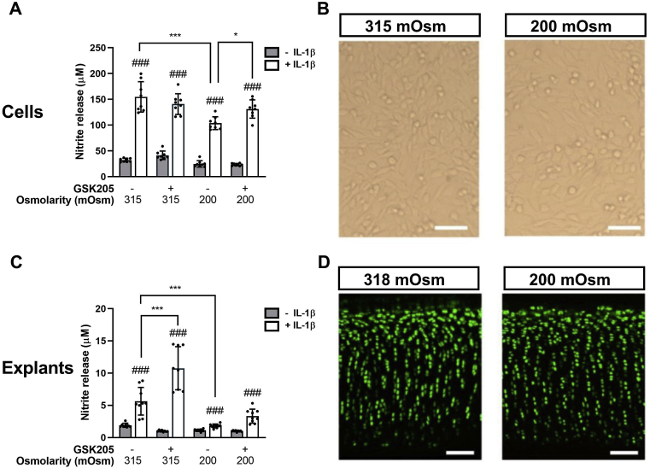
图1 低渗透刺激在分离的软骨细胞和软骨外植体中通过 TRPV4 依赖性途径抑制 IL-1β 介导的 NO 释放。
IL-1β 诱导关节软骨细胞中的初级纤毛伸长,并通过调节 IFT 介导下游分解代谢 NF-κB 信号传导。因此,实验研究了初级纤毛在TRPV4激活的抗炎机制中的参与。在分离的软骨细胞中观察到 TRPV4 纤毛定位,通过机械负荷、低渗透刺激或GSK101(1 nM)激活 TRPV4 会增加 TRPV4 纤毛定位,但对蛋白质表达没有显著影响。这些数据提示了 IFT 的改变。
在分离的软骨细胞中,IL-1β(1ng / ml)处理24h可诱导初级纤毛长度从中位数2.21-2.84 μm显著增加,而GSK101 激活 TRPV4 而消除这种效应。IL-1β介导的纤毛伸长也被机械负荷(CTS,0-10%,0.33 Hz) 和低渗透刺激阻断。GSK205抑制TRPV4恢复了IL-1β介导的纤毛在机械负荷和低渗透刺激下的伸长。这些数据表明,TRPV4激活与初级纤毛定位改变有关并调节纤毛长度。
然后,实验研究了 TRPV4 的直接药物激活是否会复制机械和渗透负荷的抗炎作用。IL-1β (1 ng/ml)诱导离体软骨细胞中NO和PGE2释放的特征性上调,而GSK101可以消除这种上调(图2 A、B)。同样,IL-1β 诱导的 COX2 表达被 GSK101 消除(图2 C)。
此前,已经确定了 HDAC6 激活和转录后微管蛋白修饰在机械负荷抗炎作用中的机制作用。同样,GSK101 导致 HDAC6 活性显著上调(图2 D),表明 TRPV4 介导的钙信号激活 HDAC6。与这一发现一致,实验观察到显著的微管蛋白去乙酰化,伴随着非聚合的可溶性微管蛋白池的减少(图2 E-F)。此外,HDAC6 特异性抑制剂 Tubacin(500 nM)恢复了 IL-1β 介导的 GSK101 处理细胞中 NO 的释放(图2 G)。这些数据表明,GSK101 模拟了机械负荷对 IL-1β 炎症信号传导、HDAC6 激活和微管蛋白修饰的影响。
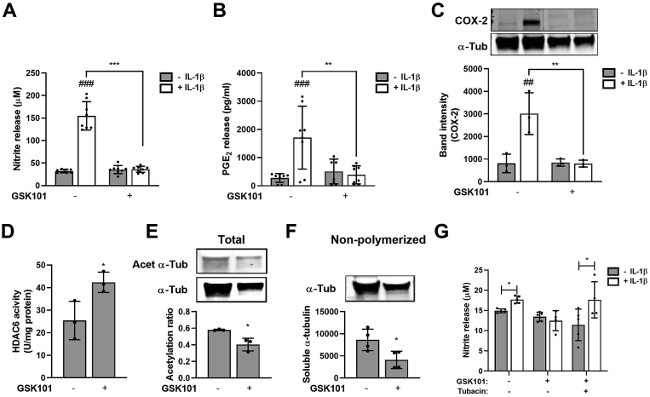
图2 TRPV4 激活通过 HDAC6 激活消除 IL-1β 炎症信号传导。
最后,实验确定了TRPV4的药物激活是否可以防止软骨退化和机械性能的丧失,将软骨外植体在1nM或10nM GSK101存在下用IL-1β处理12天。在IL-1β处理下,观察到显著的NO释放(图3 A),表明炎症信号的激活。这种反应伴随随显著的 sGAG 释放,表明软骨退化(图3 B)。
然后使用单轴无侧限压缩测量软骨组织的粘弹性,以确定 GSK101 是否可以防止 IL-1β 引起的机械性能丧失。软骨外植体呈现出以切线模量为15-20 MPa的非线性应力-应变曲线(图3 C)。随后在20% 应变下粘弹性应力松弛(图3 D),在300秒下松弛模量为2-3 MPa,代表80%的松弛,松弛半衰期约为50秒(图3 E-H)。IL-1β处理导致机械刚度急剧下降,如切线模量(图3 E)和松弛模量(图3 F)的显著降低,松弛百分比增加(图3 G)和半衰期减少(图3 H)。
GSK10显著抑制IL-1β处理后软骨外植体NO的累积释放(图3 A)。同样,sGAG的累积释放也显著减少,并且响应IL-1β的机械性能丧失被消除,因此在有和没有IL-1β的情况下,任何生物力学参数都没有显著差异。这些数据表明,TRPV4 激活消除了 IL-1β 介导的软骨退化和机械性能丧失。
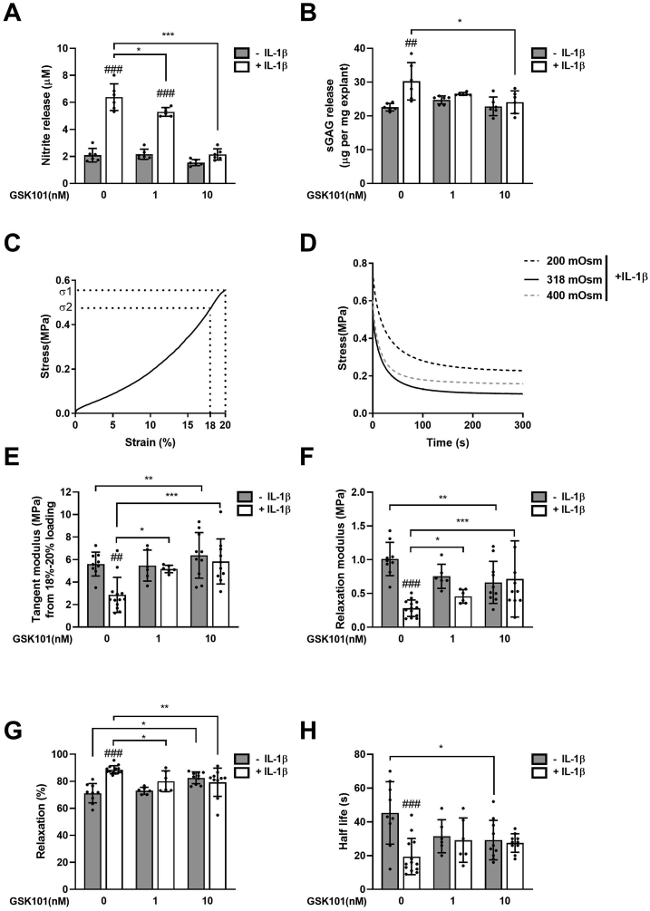
图3 TRPV4 激活抑制 IL-1β 诱导的软骨外植体中 NO 释放、基质降解和机械性能丧失。
总之,该研究证明了 TRPV4 激活在负荷下的抗炎机制中的作用。除了为该通路提供新的机制理解外,该研究还将 TRPV4 确定为潜在的治疗靶点,并证明该蛋白的药物激活可以调节炎症和其他涉及软骨疾病的 IFT 依赖性通路。
参考文献:Fu S, Meng H, Inamdar S, Das B, Gupta H, Wang W, Thompson CL, Knight MM. Activation of TRPV4 by mechanical, osmotic or pharmaceutical stimulation is anti-inflammatory blocking IL-1β mediated articular cartilage matrix destruction. Osteoarthritis Cartilage. 2021 Jan;29(1):89-99. doi: 10.1016/j.joca.2020.08.002. PMID: 33395574; PMCID: PMC7799379.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33395574/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
Naturethink牵张力|拉伸力|细胞拉伸|细胞牵张|细胞牵张应变|牵张应变细胞培养仪