硫利达嗪通过抑制 RhoA/YAP 介导的内皮炎症来防止扰动流诱导的动脉粥样硬化
动脉粥样硬化斑块主要发生在动脉的分支和弯曲处,血管内皮细胞(ECs)暴露于低剪切应力和振荡剪切应力。分叉和弯曲处的血流紊乱会促发内皮细胞炎症反应及动脉粥样硬化的发生,扰动流上调内皮细胞中粘附分子和趋化因子的表达,从而促进免疫细胞向内皮细胞的迁移、浸润和滞留。因此,靶向由血流紊乱或其他动脉粥样硬化驱动因素诱导的内皮炎症可对抗动脉粥样硬化产生有益影响。
Yes-associated protein(YAP)和具有PDZ结合结构域(TAZ)的转录共激活因子是Hippo通路的主要下游效应因子。据报道,YAP和TAZ与机械转导有关,它们整合机械信号以调节不同的细胞过程。研究表明,层流剪切应力通过整合素-Gα13-RhoA-YAP/TAZ轴抑制内皮活化和动脉粥样硬化。相反,据报道,振荡剪切应力通过整合素α5β1/c-Abl激活YAP,从而加重内皮炎症和动脉粥样硬化。这些发现表明,YAP有望作为动脉粥样硬化的治疗靶点。因此,研究的目标是寻找抑制YAP活性的药物或化合物。
在香港中文大学生物医学学院、香港城市大学生物医学系课题团队的一项研究中,将抗精神病药物硫利达嗪(Thioridazine)确定为一种有效的YAP抑制剂。在体内和体外实验中,硫利达嗪抑制了紊乱血流诱导的内皮炎症反应,此外,硫利达嗪的给药在两种小鼠动脉粥样硬化模型中发挥了抗动脉粥样硬化作用。该研究还为硫利达嗪抑制RhoA调节YAP活性的潜在机制提供了新的见解。这项研究开辟了将硫利达嗪重新用于干预动脉粥样硬化疾病的可能性。具体内容发表在Acta Pharmacologica Sinica 期刊题为“Thioridazine protects against disturbed flow-induced atherosclerosis by inhibiting RhoA/YAP-mediated endothelial inflammation”。

首先,为了寻找新的YAP抑制剂,研究人员建立了一个基于荧光素酶报告基因检测的药物筛选平台,通过从FDA药物库中筛选小分子化合物,发现抗精神病药物硫利达嗪(10 μM)可抑制内皮细胞中的YAP活性。同时,CCK-8实验表明,10 μM的硫利达嗪对HUVECs的细胞活力没有明显的毒性作用,而且促进了YAPS127的磷酸化。因此将其确定为一种新的YAP抑制剂。
为了进一步探讨硫利达嗪如何影响HUVECs,分离了硫利达嗪处理的HUVECS的总RNA用于RNA测序。KEGG富集分析证实硫利达嗪调节内皮细胞中的Hippo通路。此外,GO和GSEA分析显示,硫利达嗪处理与机械刺激和内皮活化有关。GAD疾病分析显示,差异表达基因与包括动脉粥样硬化在内的心血管疾病显著相关,表明硫利达嗪可以用作一种抗动脉粥样硬化药物。因此,RNA-seq分析提供了硫利达嗪可能保护内皮细胞免受生物力学刺激诱导的炎症和动脉粥样硬化形成的线索。
接下来,为了研究硫利达嗪是否抑制机械刺激诱导的内皮活化,对 ApoE KO 小鼠颈动脉进行了部分结扎以诱导扰动流(图1 a)。免疫荧光染色显示,硫利达嗪抑制了暴露于扰动流的内皮细胞中VCAM-1的表达(图1 b)。同时,应用平行平板系统来模拟体外扰动流(OSS,0.05 ± 0.4 Pa,1 Hz),发现硫利达嗪显著抑制OSS诱导的HUVECs促炎基因的表达(图1 d),且显著阻碍了OSS诱导的单核细胞与内皮细胞的粘附(图1 e、f)。为了进一步探讨硫利达嗪是否通过抑制 YAP 抑制内皮活化,用组成型活性 YAP (CA-YAP)转染 HUVECs,然后施加硫利达嗪和OSS,结果表明,CA-YAP的过表达逆转了硫利达嗪在暴露于扰动流的HUVEC中的抗炎作用。因此,硫利达嗪主要通过抑制YAP来抑制扰动流诱导的内皮炎症。

图1 硫利达嗪通过限制YAP活性来抑制紊乱的血流诱导的内皮炎症。
既往研究报道,细胞外刺激(如剪切应力)通过小GTPase RhoA调节YAP活性。上述RNA-seq数据的GO分析表明了硫利达嗪参与GTPase活性的调节。有趣的是,实验还观察到用硫利达嗪处理的HUEVCs的形态变化。F-肌动蛋白染色证实硫利达嗪调节细胞骨架肌动蛋白,因此,实验假设 RhoA 可能参与了硫利达嗪诱导的 Ser127 位点 YAP 磷酸化的上调。GST-RBD拉下试验证实硫利达嗪抑制HUVECs中RhoA的活性,且过表达RhoA 可消除硫利达嗪诱导的 YAP 磷酸化。这些数据表明,硫利达嗪通过抑制 RhoA 活性来上调YAPS127 的磷酸化。
然后,为了确定硫利达嗪的体内效应,实验还应用部分结扎小鼠模型来诱导扰动流(图1a、2b),将对照或硫利达嗪施用于 ApoE−/− 小鼠三周(图2 a)。结果表明,硫利达嗪减轻了动脉粥样硬化的发生(图2 c)。结扎LCA的H&E和油红O染色一致证实了硫利达嗪的抗动脉粥样硬化作用(图2 e-h)。此外,硫利达嗪抑制RhoA和YAP活性(图2 i、j),还抑制ApoE−/− 小鼠主动脉中YAP靶基因和促炎标志物的表达(图2 k、l)。
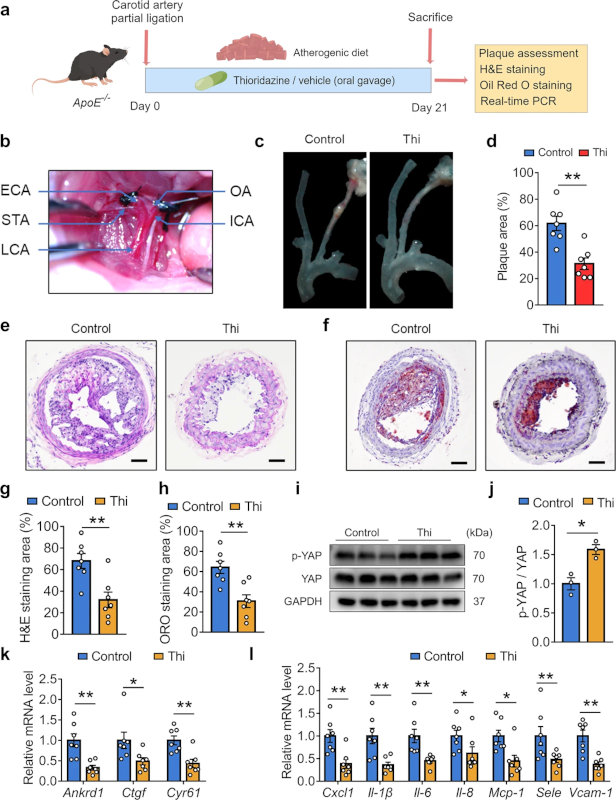
图2 口服硫利达嗪抑制ApoE−/− 小鼠部分结扎诱导的动脉粥样硬化。
最后,为了进一步研究硫利达嗪的作用,实验使用了另一种小鼠模型,其中动脉粥样硬化主要归因于高胆固醇饮食引发的高脂血症(图3 a)。油红O染色证实硫利达嗪延缓了ApoE−/− 小鼠主动脉斑块的形成(图3 b、c)。与主动脉表面染色结果一致,主动脉根部的H&E和油红O染色显示,与对照组相比,硫利达嗪处理减少了斑块面积(图3 e-h)。F4/80 免疫荧光染色表明,硫利达嗪可减少巨噬细胞向主动脉的浸润(图3 d)。值得注意的是,硫利达嗪不会引起脂质谱(图3 i)和体重的改变(图3 j),表明硫利达嗪的抗动脉粥样硬化作用与脂质无关。

图3 长期硫利达嗪处理减轻了ApoE−/−小鼠中高胆固醇饮食诱导的动脉粥样硬化。
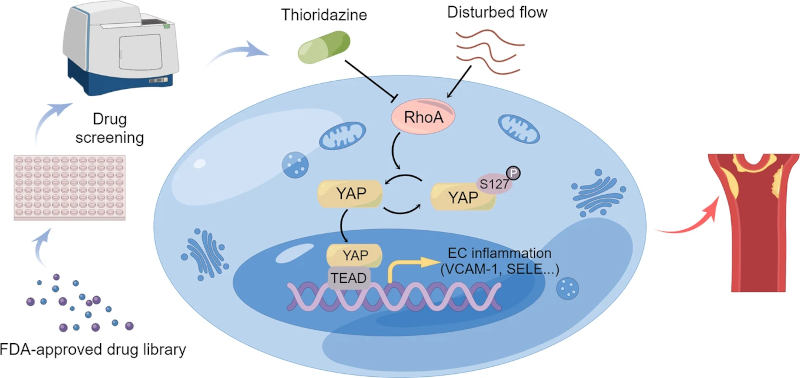
图4 将硫利达嗪重新用于抗动脉粥样硬化治疗的示意图。通过药物筛选,硫利达嗪被确定为一种有效的YAP抑制剂。硫利达嗪通过抑制 RhoA-YAP 轴抑制内皮活化和动脉粥样硬化形成。
综上所述,该研究显示,FDA批准的临床药物硫利达嗪通过RhoA-YAP信号通路抑制内皮炎症和动脉粥样硬化形成。作为一种新型的YAP抑制剂,硫利达嗪在治疗动脉粥样硬化疾病方面可能需要进一步的研究和开发。
参考文献:Jiang MC, Ding HY, Huang YH, Cheng CK, Lau CW, Xia Y, Yao XQ, Wang L, Huang Y. Thioridazine protects against disturbed flow-induced atherosclerosis by inhibiting RhoA/YAP-mediated endothelial inflammation. Acta Pharmacol Sin. 2023 Oct;44(10):1977-1988. doi: 10.1038/s41401-023-01102-w. Epub 2023 May 22. PMID: 37217602; PMCID: PMC10545737.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37217602/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.naturethink.com/
Naturethink剪切力|细胞切应力|流体剪切应力|细胞流体剪切力|fluid shear stress|细胞体外培养|仿血流剪切应力培养系统
http://www.naturethink.com/?product/58.html