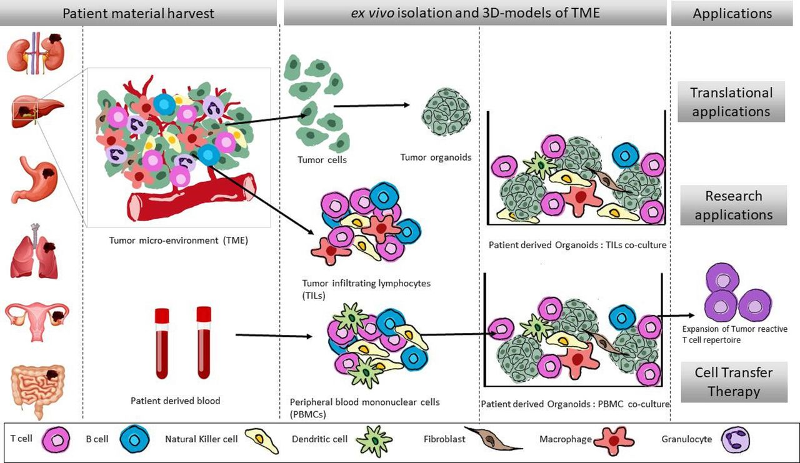
乳腺癌 MCF-7 细胞在与造血细胞和骨髓间充质干细胞/基质细胞的连续共培养过程中获得异质性
乳腺肿瘤细胞从原发性部位的亲本细胞扩散为异质性细胞群,如转移性肿瘤。异质性进展是一个复杂的动态过程,涵盖了肿瘤进展和转移的整个临床史,由肿瘤细胞和旁观者细胞(bystander cell)之间的相互作用所驱动。肿瘤微环境的各种固有细胞(resident cell)类型都与此有关。例如:造血谱系的细胞在此过程中起着驱动作用;骨髓造血干细胞生态位是异质性肿瘤细胞存活和定植的适宜空间。另一种重要的旁观者细胞类型,即间充质干细胞/基质细胞(MSCs),可能被吸引到肿瘤微环境中成为肿瘤相关的成纤维细胞,通过影响肿瘤细胞存活、治疗耐药性、血管生成和免疫逃逸来促进异质性进展。最重要的是,骨髓源性间充质干细胞(BM-MSCs)通过促进异质性肿瘤细胞定植和增殖来调节骨转移。由于肿瘤异质性进展和转移涉及与多种旁观者固有细胞类型的相互作用,因此需要合适的实验模型来剖析乳腺癌进展和转移的机制。
目前的研究使用各种共培养模型来研究肿瘤和间充质基质细胞之间的相互作用。研究发现,在共培养过程中,肿瘤细胞与旁观者细胞融合可能导致肿瘤细胞异质性。这些结果表明,肿瘤微环境中的旁观者细胞在异质性进展中起着决定性作用,并且与BM-MSCs的相互作用是肿瘤细胞获得骨转移潜力的直接途径。
在美国西达赛奈医疗中心(Cedars-Sinai Medical Center)团队的一项研究中,课题人员研究了另一个浸润肿瘤微环境的重要旁观者细胞群——造血细胞(HCs),是否可以与肿瘤细胞相互作用以促进异质性进展。实验用红色荧光蛋白(RFP)标记的人乳腺癌 MCF-7 细胞首先与 HCs共培养,然后与 BM-MSCs 共培养,通过肿瘤细胞中稳定的形态学、行为和蛋白质表达变化证实了旁观者细胞在肿瘤异质性进展中的作用。具体研究内容发表在 CELLS 期刊题为“Breast Cancer MCF-7 Cells Acquire Heterogeneity during Successive Co-Culture with Hematopoietic and Bone Marrow-Derived Mesenchymal Stem/Stromal Cells”。

造血谱系的细胞是肿瘤微环境中旁观者细胞的重要组成部分,因为各种类型的 HCs都是肿瘤浸润细胞并显示出转移趋向性。研究人员通过进行一系列的共培养实验,选择了具有代表性的红色荧光蛋白(RFP)标记的克隆RMCF7-2用于后续研究。
首先,通过将不同类型(健康供体和乳腺癌患者的PBMCs)的 HCs 与RMCF7-2 细胞单层进行共培养,发现与不同HCs共培养均可导致RMCF7-2 细胞的形态和行为变化。例如,在与乳腺癌患者的PBMCs共培养中,单层中的单个RMCF7-2细胞在第一周内会收缩,彼此失去接触,同时出现悬浮的大而圆的红色荧光细胞。第二周,附着的RMCF7-2细胞数量减少,大部分细胞脱离,采用悬浮生长(图1)。这说明,上皮细胞RMCF7-2与HCs共培养后采取悬浮生长的模式。
细胞间接触的丧失似乎是一种先天或程序性的反应,因为在RMCF7-2细胞与所有11种人类和6种小鼠HCs 共培养中也观察到相同的反应。这一系列的共培养物表明,无论使用哪种类型的HCs,RMCF7-2细胞都会以相似的形态和行为变化做出反应。由此可见,直接接触存活的HCs能够诱导RMCF7-2细胞改变形态和生长行为。

图1 RMCF7-2 与 HCs 共培养过程中的形态和生长行为。
为了评估观察到的变化是短暂的还是永久性的,使用 G418(300 μg/mL)处理共培养物清除剩余的 HCs,留下悬浮的红色荧光细胞继续培养,发现来自共培养物的红色荧光细胞在第 15 次传代后仍保持增殖,表明获得性悬浮生长是一种稳定的表型。然后建立了用于详细分析的克隆细胞(MAF-2 和MAF-12)(图2),进行持续的传代以进一步评估克隆细胞在悬浮生长中的稳定性。尽管这些悬浮的衍生克隆的生长速度通常比亲本RMCF7-2细胞慢,但都没有失去悬浮生长的迹象。因此,HC样形态和悬浮液生长的获得特征是相当稳定的。
接下来,为了描述伴随形态和行为转换的基因表达变化,实验通过MCF-7细胞标记蛋白来检测分离的衍生克隆细胞,蛋白质印迹法鉴定实质性的表达变化。结果观察到,第30次传代的 MAF-2和 MAF-12克隆表达显著降低的 ERα。另一个突出的变化是PR表达的丢失。相比之下,尽管EGFR1水平升高,但ERβ或Her2/neu水平几乎没有变化。有趣的是,当这些细胞放弃上皮形态时,大量的E-cad持续存在,尽管水平较低,而在这些细胞中未检测到波形蛋白。从第30代到第60次传代,表达变化持续存在。这些结果表明,稳定的表型转换伴随着基因表达的稳定变化。
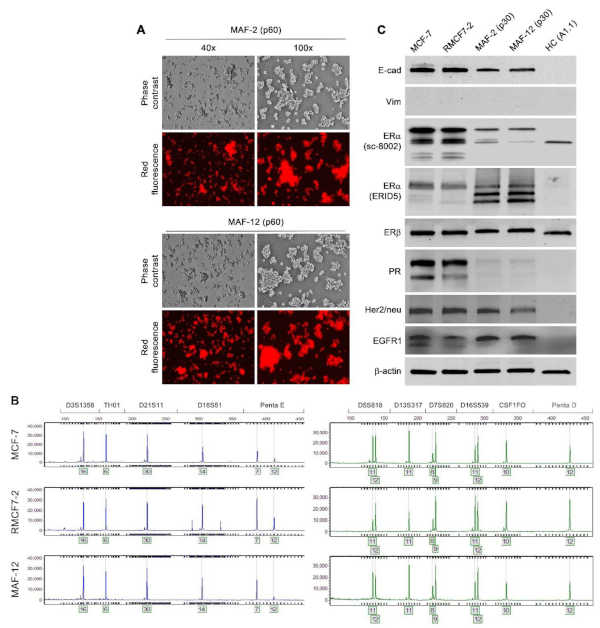
图2 将RMCF7-2与乳腺癌患者PBMCs 共培养分离的MAF-2和MAF-12克隆以1:5的重复比例进行连续培养。在传代60次时拍摄细胞图像。
乳腺癌经常转移到骨骼。在此过程中,转移细胞可能会与不同的旁观者细胞(包括BM-MSCs)发生连续相互作用。因此,实验将克隆的 MAF-2 与 MAF-12 细胞和 hBM-MSCs 进行了另一轮共培养,并监测共培养中的细胞形态和生长行为。
第二轮共培养的观察结果显示,悬浮生长中的MAF-2和MAF-12细胞在基质单层存在下恢复了附着生长。肿瘤细胞和hBM-MSCs之间经常发生细胞融合事件(图3A),表现为红色荧光细胞,但具有hBM-MSCs形态。在第三周,红色荧光细胞开始成群出现,很可能是因为克隆扩增(图3 B)。这些细胞呈短纺锤形,没有细胞间接触,分散排列或重叠生长,而一些附着生长的细胞仍然保持圆形细胞形状(图3 A、B)。在4 周的共培养结束时,hBM-MSCs 单层细胞充满了异质性肿瘤细胞簇,代表具有不同克隆形态和生长行为的单个红色荧光克隆。这些结果再次证明,与旁观者细胞的相互作用改变了肿瘤细胞的形态和生长行为。由于肿瘤-间充质干细胞相互作用发生在单个细胞之间,因此这种相互作用可能会单独影响癌细胞,从而导致克隆间异质性。

图3 与 hBM-MSCs 进行第二轮共培养,使 MAF-2 和 MAF-12 细胞的附着生长行为发生改变。
为了分离与 hBM-MSCs 共培养 4 周后恢复附着生长的红色荧光癌细胞,加入 G418 以清除基质细胞,然后进行克隆,报告显示了MAF-2与hBM-MSCs共培养的5个克隆细胞(MAF-BMSC-1—5)的形态。不同的形态和恢复的附着生长行为是稳定的。然后进行了另一轮蛋白质印迹分析以评估标记蛋白表达的状态。尽管重新采用了附着生长,但所有五个 MAF-BMSC 克隆都更接近亲本 MAF-2 细胞的表达模式,显示 ERα 表达降低、PR 表达丢失和 EGFR1 水平升高。但E-cad水平仍然很低,波形蛋白仍然检测不到。因此,从第二轮共培养中分离的克隆与亲本 MAF-2 和祖代 RMCF7-2 细胞都具有离散的异质性。
最后,实验评估了连续共培养是否会导致与亲代细胞行为异质性的癌细胞变化。与RMCF7-2细胞相比,从连续共培养(MAF-BMSC-1、-3和-5)中选择的克隆细胞均显示出更快的细胞增殖(图4 A)、更高的迁移能力(图4 B)和较大的异种移植肿瘤形成(图4 C),尽管行为变化在克隆细胞之间的程度不同。有趣的是,MAF-2 和 MAF-12 的增殖和迁移都很缓慢(图4 A、B),而使用相同接种方案的重复动物研究表明 MAF-2 和 MAF-12 细胞不能形成异种移植肿瘤(图4 C)。因此,未来需要进一步检查以确定RMCF7-2和HC共培养的其他克隆细胞是否也失去了异种移植肿瘤形成的潜力。
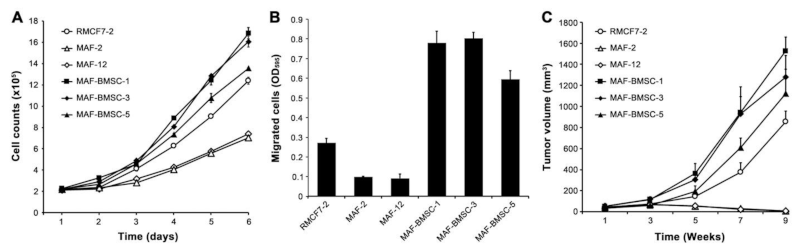
图4 与旁观者细胞共培养诱导行为异质性。将选定的MAF-BMCS克隆(-1、-3和-5)与亲本MAF克隆(-2和-12)和祖本RMCF7-2克隆的行为变化进行比较。
总之,该研究使用连续共培养来模拟骨肿瘤微环境中癌细胞与浸润的HCs和固有BM-MSCs的相互作用,表明在连续共培养下,与旁观者细胞的相互作用会引起永久性的形态学、生长行为和基因表达变化,这是研究乳腺癌进展和转移过程中肿瘤细胞异质性的有力模型。与这项研究相关的是,需要对其他 MAF 克隆进行额外的行为分析,以确定 RMCF7-2 和 HCs 之间的共培养是否使悬浮液中的所有癌细胞在相同参数下侵袭性降低,还需要分析其他基因表达变化,以揭示第二轮共培养后新获得的侵袭性的其他伴随表达变化。肿瘤细胞异质性证实了乳腺癌进展和转移的过程,肿瘤细胞异质性处于动态状态,最有可能由肿瘤细胞和旁观者细胞之间的持续相互作用来维持。阐明肿瘤细胞异质性进展的机制是肿瘤转移研究的目标。
参考文献:Wang R, Wang X, Yin L, Yin L, Chu GC, Hu P, Ou Y, Zhang Y, Lewis MS, Pandol SJ. Breast Cancer MCF-7 Cells Acquire Heterogeneity during Successive Co-Culture with Hematopoietic and Bone Marrow-Derived Mesenchymal Stem/Stromal Cells. Cells. 2022 Nov 10;11(22):3553. doi: 10.3390/cells11223553. PMID: 36428982; PMCID: PMC9688235.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36428982/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.naturethink.com/
Naturethink多细胞培养|共培养体系|共培养模型|共培养实验|动态细胞共培养|仿血流多细胞动态共培养系统
http://www.naturethink.com/?product/81.html